酞菁
| 酞菁(母核) | |
|---|---|

| |
| 英文名 | Phthalocyanine |
| 識別 | |
| CAS號 | 574-93-6 |
| PubChem | 5282330 |
| ChemSpider | 4445497 |
| SMILES |
|
| InChI |
|
| InChIKey | IEQIEDJGQAUEQZ-UHFFFAOYAC |
| 性質 | |
| 化學式 | C32H18N8 |
| 莫耳質量 | 514.54 g·mol⁻¹ |
| 外觀 | 深藍色、紫色至黑色結晶 |
| 熔點 | > 300 °C |
| 沸點 | 550 °C (升華) |
| 溶解性 | 難溶於水,溶於硫酸 |
| 危險性 | |
| 安全術語 | S:S22, S24/25 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
酞菁(Phthalocyanine),是一類大環化合物,環內有一個空腔,直徑約2.7 × 10−10m。中心腔內的兩個氫原子可以被70多種元素取代,包括幾乎所有的金屬元素和一部分非金屬元素。酞菁環的配位數是四,依金屬的原子尺寸和氧化態,一個或兩個(對部分鹼金屬而言)金屬原子可以嵌入酞菁的中心腔內。如果金屬趨向於更高的配位數,金屬酞菁的分子會呈角錐體,四面體或八面體結構。錒系和鑭系金屬是八配位的,這兩個系的金屬酞菁呈現三明治型結構。
歷史
[編輯]1907年Braun和Tehemiac兩人[1]在一次實驗中偶然得到了一種藍色物質,當時他們兩人正在研究鄰氰基苯甲醯胺的化學性質,當他們將這種無色的物質加熱後得到了微量的藍色物質,這就是現在被人們稱為酞菁的化合物。1923年Diesbach等人[2]發現可以用鄰二苄溴與氰化亞銅反應製得鄰二苄腈,於是他們想用鄰二溴苯與氰化亞銅反應來製備鄰苯二腈。可實驗結果出乎他們的意料,他們並未得到所期望的鄰苯二腈,而是得到一種深藍色的物質,並且產率達到23%。這種藍色物質就是現在被稱為酞菁銅的化合物。至此,酞菁和金屬酞菁化合物被發現。直到1929年,在英國的ICI公司的資助下,英國倫敦大學的Linstead教授和他的合作者開始進行這類新物質的結構測定工作。1933年他們用元素分析、質譜和氧化降解(分解產物確定為鄰苯二甲醯亞胺)等手段測定了該類化合物的結構,Linstead教授便用phthalocyanine(Pc)一詞來描述這類新化合物。
概述
[編輯]1935年Linstead教授和他的合作者採用500℃以上的高溫和低氣壓,用CO2作載氣製得了酞菁化合物的單晶。Robertson教授用X射線衍射分析法對酞菁及幾種金屬酞菁(包括鎳酞菁,銅酞菁和鉑酞菁)的單晶進行結構分析,根據他的報道,酞菁及鎳酞菁、銅酞菁和鉑酞菁等的分子所組成的晶體屬單斜晶體,空間群為P2/a。每個晶胞中有兩個酞菁分子,每個酞菁分子都呈現出高度平面的結構。所得分子結構的結果與Linstead教授的結果完全一致,從而酞菁的化學結構得到了進一步的證實。酞菁環本身是一個具有18個π電子的大π體系,因此其電子密度非常均勻,以致分子中的四個苯環很少變形,並且各個C-N鍵的鍵長几乎相等。它可以看做是四苯並卟啉的四氮雜衍生物。
酞菁是一類大環化合物,環內有一個空腔,直徑約2.7 × 10−10m。中心腔內的兩個氫原子可以被70多種元素取代,包括幾乎所有的金屬元素和一部分非金屬元素。酞菁環的配位數是四,依金屬的原子尺寸和氧化態,一個或兩個(對部分鹼金屬而言)金屬原子可以嵌入酞菁的中心腔內。如果金屬趨向於更高的配位數,金屬酞菁的分子會呈角錐體,四面體或八面體結構。錒系和鑭系金屬是八配位的,這兩個系的金屬酞菁呈現三明治型結構。
酞菁分子中心是一個由碳氮共軛雙鍵組成的18-π體系,它的吸收譜可見區680nm和近紫外區340nm處有強吸收峰,分別稱作Q帶和B帶(Soret帶)這兩個帶尤其是Q帶是酞菁類化合物的特徵吸收帶,可以作為酞菁成環的標誌。
酞菁是第一個使用X射線技術確定結構的有機化合物,酞菁存在強的電子流,滿足了高分辨電子顯微鏡的要求,可以得到分子和亞分子分辨的有機分子圖象。大多數酞菁化合物具有同質多晶性,即結構相同的酞菁分子在不同的環境中所生成的晶體結構是不同的。這些特殊晶型的酞菁被作為光導體材料用在電子照相和雷射印表機上。酞菁的電性質研究表明,該類化合物是一種有機半導體,帶隙寬度為1.5ev左右,一般是p型半導體,通過改變酞菁環上的取代基和中心金屬的類型可以修飾或改變酞菁的性能,得到性能各異的功能材料,當酞菁周邊的取代基連上強拉電子取代基如 -F 和 -CN 等時,甚至可以轉化為n型半導體。
合成
[編輯]酞菁通常由鄰苯二醯衍生物的環化四聚合反應合成,即鄰苯二甲酸、鄰苯二甲酸酐、鄰苯二甲醯亞胺、鄰苯二腈、1,2-二溴苯或1,3-二亞氨基異吲哚啉。製備金屬衍生物最常用的方法是鄰苯二腈的金屬模板反應,而1,3-二亞氨基異吲哚啉是用於獲得非金屬酞菁。製備非金屬酞菁的另一種方法是用醇鈉或醇鋰處理鄰苯二腈,可以得到鹼金屬酞菁,緊接著用無機酸去掉金屬得到非金屬酞菁。而且,在對苯二酚、四氫嘧啶存在下加熱鄰苯二腈可獲得非金屬酞菁。目前,最常用的方法是通過鄰苯二腈和異吲哚啉在高沸點有機溶劑中合成酞菁,用這兩種前體合成酞菁的優勢在於易提純及產率較高。

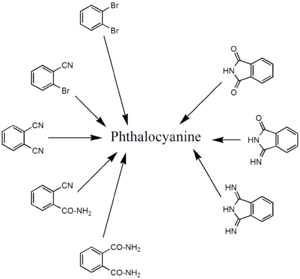
相關化合物
[編輯]
參考資料
[編輯]- ^ A. Braun, J. Tcherniac. Über die Produkte der Einwirkung von Acetanhydrid auf Phthalamid. Berichte der deutschen chemischen Gesellschaft. 1907, 40 (2): 2709–2714. doi:10.1002/cber.190704002202.
- ^ Henri de Diesbach, Edmond von der Weid. Quelques sels complexes des o-dinitriles avec le cuivre et la pyridine. Helvetica Chimica Acta. 1927, 10 (1): 886–888. doi:10.1002/hlca.192701001110.
|
