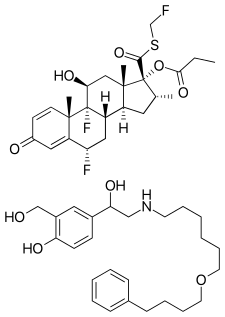
氟替卡松/沙美特羅
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Advair、Seretide (舒樂泰、舒利迭)、Cyplos及其他 |
| AHFS/Drugs.com | FDA專業藥物信息 |
| MedlinePlus | a699063 |
| 懷孕分級 |
|
| 給藥途徑 | 吸入肺部 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 識別資訊 | |
| CAS號 | 136112-01-1 |
| PubChem CID | |
| ChemSpider | |
| KEGG | |
氟替卡松/沙美特羅(英語:Fluticasone/salmeterol)以Advair、Seretide (舒樂泰、舒利迭) 等商品名在市面銷售,是一種含有氟替卡松丙酸酯和沙美特羅的固定劑量複方藥。[2]用於治療氣喘和慢性阻塞性肺病 (COPD)。[2]透過將藥品吸入肺部來使用。[2]
用藥後常見的副作用有鵝口瘡、頭痛和咳嗽。[3]嚴重的副作用可能有氣喘惡化、過敏反應、癲癇發作和心臟問題。[3]個體於懷孕和母乳哺育時期使用的安全性尚不清楚。[4]氟替卡松是一種皮質類固醇,透過減少發炎發揮而作用,而沙美特羅是一種長效β-腎上腺素受體激動劑 (LABA),透過活化β-2腎上腺素受體發揮作用。[3]
此複方藥於2000年在美國被批准用於醫療用途。[3]其通用名藥物於2019年在美國獲得批准。[5]它是美國2020年排名第56的最常使用的處方藥,開立的處方箋數量超過1,100萬張。[6][7]
醫療用途
[編輯]氟替卡松是一種皮質類固醇,是複方藥中的抗發炎成分,可減少肺部發炎而改善呼吸。沙美特羅是一種LABA,可治療氣道收縮作用。兩者的作用為維持治療,而非作為突發症狀的救治使用。
副作用
[編輯]此複方藥的常見副作用與其兩成分個別使用的副作用相同。例如,使用吸入性皮質類固醇與口腔念珠菌病(通常稱為酵母菌感染或鵝口瘡)有關。吸入藥物後用水漱口可降低發生這種情況的風險。
雖然使用吸入性類固醇和LABA可控制及改善氣喘症狀,[8]但有人擔心沙美特羅可能會增加因氣喘而死亡的風險,而這種額外風險並不會因為添加吸入類固醇而降低。[9]這種複方藥的其他副作用可能有血壓升高、心率變化,以及心律不整、骨質疏鬆、白內障和青光眼的風險增加。[10]研究證明吸入氟替卡松丙酸酯對兒童屬於安全。 於2013年發表的一項系統性回顧發現吸入氟替卡松長達三個月,對罹患氣喘兒童的下視丘-垂體-腎上腺軸 功能、生長和骨礦物質密度沒顯著的不利影響。[11]
作用機轉
[編輯]氟替卡松/沙美特羅含有氟替卡松丙酸酯(一種合成皮質類固醇)和沙美特羅(一種選擇性長效β-腎上腺素受體激動劑)。氟替卡松是一種有效的抗發炎劑,可抑制多種細胞類型,如肥大細胞、嗜酸性球、嗜鹼性球、淋巴球、巨噬細胞和嗜中性球,所有這些細胞都會導致發炎,而發炎是氣喘發病機制的重要組成部分。沙美特羅透過刺激細胞內腺苷酸環化酶發揮作用,腺苷酸環化酶在環腺苷酸的產生中充當催化劑。環酸腺苷水平升高導致支氣管平滑肌鬆弛。此外,環酸腺苷可抑制速發型超敏反應介質的釋放。[12]
社會與文化
[編輯]法律地位
[編輯]歐洲藥品管理局(EMA)人用藥品委員會(CHMP)於2021年1月28日採納正面意見,建議授予用名為Seffalair Spiromax作治療氣喘藥品的營銷核准。.[13]藥品的申請人是梯瓦製藥公司。[13]CHMP也建議授予名為BroPair Spiromax藥品的複製品以營銷核准。[14]Seffalair Spiromax和BroPair Spiromax皆於2021年3月從歐盟獲准用作醫療用途。[15][16][17][18]
通用名藥物
[編輯]美國食品藥物管理局(FDA)於2019年1月授予邁蘭製藥首項名為Advair Diskus的通用名藥物批准。[19]
民事和解
[編輯]Advair於2012年成為葛蘭素史克 (GSK) 藥廠與美國政府之間一項較大型民事和解協議的一部分,其中葛蘭素史克同意支付10.43億美元和解金。美國政府表示葛蘭素史克有從事推廣Advair的仿單標示外使用,並向醫療保健專業人員支付回扣以推廣該藥品銷售等行為。[20]
參考文獻
[編輯]- ^ Seroflo Multihaler (Cipla Australia Pty Ltd). Department of Health and Ages Care. [2023-04-01]. (原始內容存檔於2022-11-22).
- ^ 2.0 2.1 2.2 British national formulary : BNF 76 76. Pharmaceutical Press. 2018: 263–264. ISBN 9780857113382.
- ^ 3.0 3.1 3.2 3.3 Fluticasone and Salmeterol inhalation - FDA prescribing information, side effects and uses. Drugs.com. [2019-03-04]. (原始內容存檔於2019-03-06) (英語).
- ^ Fluticasone / salmeterol Pregnancy and Breastfeeding Warnings. Drugs.com. [2019-03-03]. (原始內容存檔於2019-03-06) (英語).
- ^ Office of the Commissioner. Press Announcements - FDA approves first generic Advair Diskus. www.fda.gov. [2019-02-01]. (原始內容存檔於2019-02-06).
- ^ The Top 300 of 2021. ClinCalc. [2024-01-14]. (原始內容存檔於2024-01-15).
- ^ Fluticasone; Salmeterol - Drug Usage Statistics. ClinCalc. [2024-01-14]. (原始內容存檔於2021-10-19).
- ^ Guideline 101: British Guideline on the Management of Asthma. British Thoracic Society & Scottish Intercollegiate Guidelines Network (SIGN). (原始內容存檔於2015-04-18).
- ^ Salpeter SR, Buckley NS, Ormiston TM, Salpeter EE. Meta-analysis: effect of long-acting beta-agonists on severe asthma exacerbations and asthma-related deaths. Ann. Intern. Med. June 2006, 144 (12): 904–12. PMID 16754916. doi:10.7326/0003-4819-144-12-200606200-00126
 .
.
- ^ US fluticasone propionate/Salmeterol label (PDF). FDA. April 2016 [2024-02-05]. (原始內容存檔 (PDF)於2016-11-30).
- ^ Muley P, Shah M, Muley A. Safety of inhaled fluticasone propionate therapy for pediatric asthma - a systematic review. Current Drug Safety. July 2013, 8 (3): 186–194. PMID 23859431. doi:10.2174/15748863113089990038.
- ^ Advair Diskus 100/50 (PDF). Food and Drug Administration. [2019-10-30]. (原始內容存檔 (PDF)於2021-01-23).
- ^ 13.0 13.1 Seffalair Spiromax: Pending EC decision. European Medicines Agency (EMA). 2021-02-01 [2021-02-01]. (原始內容存檔於2021-02-10).
- ^ BroPair Spiromax: Pending EC decision. European Medicines Agency (EMA). 2021-02-01 [2021-02-01]. (原始內容存檔於2021-04-13).
- ^ Seffalair Spiromax EPAR. European Medicines Agency (EMA). 2021-01-25 [2021-08-23]. (原始內容存檔於2023-11-29).
- ^ BroPair Spiromax EPAR. European Medicines Agency (EMA). 2021-01-25 [2021-08-23]. (原始內容存檔於2023-11-05).
- ^ Seffalair Spiromax Product information. Union Register of medicinal products. [2023-03-03]. (原始內容存檔於2023-03-05).
- ^ BroPair Spiromax Product information. Union Register of medicinal products. [2023-03-03]. (原始內容存檔於2023-03-05).
- ^ FDA approves first generic Advair Diskus. U.S. Food and Drug Administration (FDA). 2020-03-24 [2024-02-05]. (原始內容存檔於2019-02-06).
- ^ GlaxoSmithKline to Plead Guilty and Pay $3 Billion to Resolve Fraud Allegations and Failure to Report Safety Data. Department of Justice: Office of Public Affairs. 2012-07-02 [2024-02-05]. (原始內容存檔於2021-04-21).
外部連結
[編輯]- Fluticasone propionate mixture with salmeterol. Drug Information Portal. U.S. National Library of Medicine. [2024-02-05]. (原始內容存檔於2022-05-14).
- Fluticasone propionate mixture with salmeterol xinafoate. Drug Information Portal. U.S. National Library of Medicine. [2024-02-05]. (原始內容存檔於2022-10-15).
