價殼層電子對互斥理論
價殼層電子對互斥理論(英語:Valence Shell Electron Pair Repulsion,簡稱為VSEPR),是一個用來預測單個共價分子形態的化學模型。理論通過計算中心原子的價層電子數和配位數來預測分子的幾何構型,並構建一個合理的路易斯結構式來表示分子中所有鍵和孤對電子的位置。
價殼層電子對互斥理論也稱為吉萊斯皮-尼霍姆理論,因為該理論的兩位主要創始人分別是羅納德·吉萊斯皮和羅納德·尼霍姆。
歷史
[編輯]1939 年,日本化學家槌田·龍太郎(Ryutaro Tsuchida)首先提出分子結構與價層電子對數量之間關係[1]。
1940年,由內維爾·席德維克和 赫伯特·包維爾(Herbert Powell)在牛津大學的貝克獎獲獎講座上獨立提出[2]。
1957 年,倫敦大學學院的羅納德·吉萊斯皮和羅納德·尼霍姆將這一概念提煉為更詳細的理論[3][4]。
理論基礎
[編輯]價殼層電子對互斥理論的基礎是,分子或離子的幾何結構主要決定於與中心原子相關的電子對之間的排斥作用。該電子對既可以是成鍵的,也可以是沒有成鍵的(叫做孤對電子)。只有中心原子的價電子才能夠對分子的形狀產生有意義的影響。
分子中電子對間的排斥的三種情況為:
- 孤對電子間的排斥(孤-孤排斥);
- 孤對電子和成鍵電子對之間的排斥(孤-成排斥);
- 成鍵電子對之間的排斥(成-成排斥)。
分子會盡力避免這些排斥來保持穩定。當排斥不能避免時,整個分子傾向於形成排斥最弱的結構(與理想形狀有最小差異的方式)。
孤對電子間的排斥被認為大於孤對電子和成鍵電子對之間的排斥,後者又大於成鍵電子對之間的排斥。因此,分子更傾向於最弱的成-成排斥。
配位基較多的分子中,電子對間甚至無法保持90°的夾角,因此它們的電子對更傾向於分布在多個平面上。
空間位數
[編輯]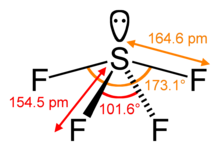
分子的空間位數(steric number)是指其中心原子鍵結原子的個數(σ鍵)加上中心原子的孤電子對數量。空間位數常用在價殼層電子對互斥理論(VSEPR)中確認分子的形狀,也會用在分子結構研究中。
在用VSEPR理論預測分子形狀時,計算空間位數是其中的一個重要步驟。例如針對分子四氟化硫,中心的硫原子有四個配位基,因此其配位數為4。但中央原子仍留有一對孤電子對,因此其空間位數是5。有了中心原子的空間位數配合其孤電子對數,就可以預測其分子形狀。
實際預測
[編輯]下面是價殼層電子對互斥理論預測的分子形狀表。
| 電子對數 | 混成類型(混層類型) | 軌域形狀 | 單電子對數(孤電子對) | 分子形狀 | 例 |
|---|---|---|---|---|---|
| 2 | sp | 直線形 | 0 | 直線形 | BeCl2、CO2 |
| 3 | sp2 | 平面正三角形 | 0 | 平面正三角形 | BCl3 |
| 1 | V字形(角形、彎曲形) | SO2 | |||
| 4 | sp3 | 正四面體 | 0 | 正四面體 | CH4 |
| 1 | 三角錐 | NH3 | |||
| 2 | V字形(角形、彎曲形) | H2O | |||
| 5 | sp3d | 三角雙錐 | 0 | 三角雙錐 | PCl5 |
| 1 | 變形四面體(蹺蹺板形) | TeCl4 | |||
| 2 | T字形 | ClF3 | |||
| 3 | 直線形 | I3− | |||
| 6 | sp3d2 | 正八面體 | 0 | 正八面體 | SF6 |
| 1 | 四方錐 | IF5 | |||
| 2 | 平面十字形 | ICl4− | |||
| 3 | T字形 | ||||
| 4 | 直線形 | ||||
| 7 | sp3d3 | 五角雙錐 | 0 | 五角雙錐 | IF7 |
| 1 | 五角錐 | ||||
| 2 | 五角形 |
下圖中,價殼層電子對互斥理論常用AXE方法計算分子構型。這種方法也叫ABE,其中A代表中心原子,X或B代表配位原子,E代表孤電子對。
| 電子對數 | 沒有孤電子對 (基本形狀) |
1個孤電子對 | 2個孤電子對 | 3個孤電子對 |
|---|---|---|---|---|
| 2 | 直線形 |
|||
| 3 |  平面三角形 |
 角形 |
||
| 4 |  四面體形 |
 三角錐形 |
 角形 |
|
| 5 |  三角雙錐形 |
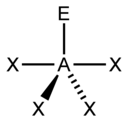 變形四面體形 |
 T字形 |
 直線形
|
| 6 |  八面體形 |
 四角錐形 |
 平面四方形 |
|
| 7 |  五角雙錐形 |
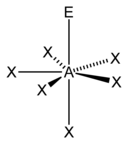 五角錐形 |
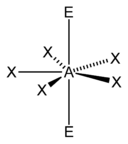 平面五角形 |
|
| 8 |
下圖中:孤電子對以淡黃色球體表示。分子形狀為實際幾何構型,即不包含孤對電子的構型。
| 分子類型 | 分子形狀 | 中心原子價電子對的組態方式† | 分子的幾何構型‡ | 實例 |
|---|---|---|---|---|
| AX1En | 雙原子分子 (直線形) |
HF、O2 | ||
| AX2E0 | 直線形 | BeCl2、HgCl2、CO2 | ||
| AX2E1 | 角形 | 
|

|
NO2−、SO2、O3 |
| AX2E2 | 角形 | 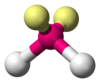
|

|
H2O、OF2 |
| AX2E3 | 直線形 | 
|
XeF2、I3− | |
| AX3E0 | 平面三角形 | 
|

|
BF3、CO32−、NO3−、SO3 |
| AX3E1 | 三角錐形 | 
|

|
NH3、PCl3 |
| AX3E2 | T字形 | 
|

|
ClF3、BrF3 |
| AX4E0 | 四面體形 | 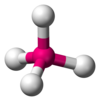
|

|
CH4、PO43−、SO42−、ClO4− |
| AX4E1 | 變形四面體形 | 
|
|
SF4 |
| AX4E2 | 平面四方形 | 
|

|
XeF4 |
| AX5E0 | 三角雙錐形 | 
|

|
PCl5 |
| AX5E1 | 四角錐形 | 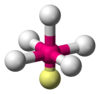
|

|
ClF5、BrF5 |
| AX5E2 | 平面五角形 | 
|

|
XeF 5- |
| AX6E0 | 八面體形 | 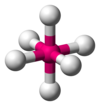
|

|
SF6 |
| AX6E1 | 五角錐形 | 
|

|
XeOF 5−、IOF 52− [5] |
| AX7E0 | 五角雙錐形 | 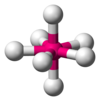
|

|
IF7 |
| AX8E0 | 四方反稜柱形 | 
|

|
XeF2− 8, ZrF84-, ReF8- |
| AX9E0 | 三側錐三角柱 | 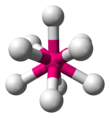
|

|
ReH2− 9 |
範例
[編輯]甲烷分子(CH4)是四面體結構,是一個典型的AX4型分子。中心碳原子周圍有四個電子對,四個氫原子位於四面體的頂點,鍵角(H-C-H)為109°28'。
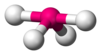
一個分子的形狀不但受配位原子影響,也受孤對電子影響。氨分子(NH3)中心原子混成類型與甲烷相同(sp3),分子中有四個電子雲密集區,電子雲分佈依然呈四面體。其中三個是成鍵電子對,另外一個是孤對電子。雖然它沒有成鍵,但是它的排斥力影響著整個分子的形狀。因此,這是一個AX3E型分子,整個分子的形狀是三角錐形,因為孤對電子是不可「見」的。
事實上,電子對數為七是有可能的,軌道形狀是五角雙錐。但是它們僅存在於不常見的化合物之中,比如在六氟化氙中,有一對孤電子,它的構型趨向於八面體結構,因為孤對電子傾向於位於五角形的平面上。另一個例子為七氟化碘,碘沒有孤電子,七個氟原子呈五角雙錐狀排列。
電子對數為八也是有可能的,這些化合物一般為四方反稜柱體結構,[6] 例子有八氟合氙酸亞硝醯中的 [XeF8]2− 離子[7][8] 以及八氰合鉬(Ⅳ)陰離子 [Mo(CN)8]4− 和八氟合鋯(Ⅳ)陰離子 [ZrF8]4−。
例外
[編輯]在一些化合物中VSEPR理論不能正確的預測分子空間構型。
過渡金屬化合物
[編輯]許多過渡金屬化合物的幾何構型不能用VSEPR理論解釋,可以歸結於價層電子中沒有孤對電子以及核心的d電子與配位基的交互作用。[9] 這些化合物的結構可以用VALBOND理論預測,包括金屬氫化物和烷基錯合物(例如六甲基鎢),這個理論的基礎是sd 混成軌域和三中心四電子鍵模型。[10][11] 晶場理論是另一個經常可以解釋錯合物幾何構型的理論。
IIA族鹵化物
[編輯]較重鹼土金屬的三原子鹵化物的氣相結構(例如:鈣、鍶、鋇的鹵化物,MX2)並不像預測的那樣為直線形,而是V形。(X-M-X的大致鍵角: CaF2,145°;SrF2,120°;BaF2,108°;SrCl2,130°;BaCl2,115°;BaBr2,115°;BaI2,105°)。[12] 羅納德·吉萊斯皮提出這是因為配位基與金屬原子的內層電子發生交互作用,極化使得內層電子雲不是完全球面對稱,因此導致了分子結構的變化。[9][13]
AX2E0型分子
[編輯]根據計算,較重的碳族元素炔烴類似物(RM≡MR,其中M = Si、Ge、Sn、Pb)的結構是角形。[14][15][16]
AX2E2型分子
[編輯]一個例子是氧化鋰分子,即Li2O,它的中間構型是直線形而不是彎曲的,這一點可以歸結於如果構型是彎曲的,鋰原子之間將產生強烈的排斥作用。[17]
另一個例子是O(SiH3)2(二甲矽醚)的Si-O-Si鍵的鍵角為144.1°,與其他分子中的鍵角相比差別較大,比如Cl2O (110.9°)、(CH3)2O (111.7°)以及N(CH3)3 (110.9°)。格萊斯皮的合理解釋是孤對電子的位置不同。當配位基的電負度與中心原子類似或更大時,孤對電子有能力排斥其他電子對,導致鍵角較小。 [9] 當中心原子電負度較大時,就像O(SiH3)2中,孤對電子的定域不明顯,排斥作用較弱,這種結合導致了強配位基之間的排斥(-SiH3與上面的例子相比是一個比較大的配位基),使得Si-O-Si鍵的鍵角比預想的要大。[9]
一些形如AX6E1的分子
[編輯]一些AX6E1型分子,例如含有Te(IV)或Bi(III)離子的化合物如TeCl62−、TeBr62−、BiCl63−、BiBr63−和BiI63−是正八面體結構;其孤對電子並不影響其構型[18]。 一種合理化解釋是因為配位基原子排列的擁擠沒有給孤對電子留下空間[9];另一種合理化解釋是惰性電子對效應。[19]
與其他相關理論的對比
[編輯]價殼層電子對互斥理論、價鍵理論和分子軌域理論都是關於分子如何構成的理論。價鍵理論主要關注於σ鍵和π鍵的形成,通過研究受成鍵情況影響的軌域形狀描述分子的形狀。價鍵理論也會藉助VSEPR。分子軌域理論則是關於原子和電子是如何組成分子或多原子離子的一個更精密的理論。
參考資料
[編輯]- ^ 龍太郎, 槌田. 新簡易原子價論. 日本化學會誌. 1939, 60 (3) [2024-04-13]. doi:10.1246/nikkashi1921.60.245. (原始內容存檔於2024-06-03).
- ^ Bakerian Lecture: Stereochemical types and valency groups. Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences. 1940-10-09, 176 (965) [2024-04-13]. ISSN 0080-4630. doi:10.1098/rspa.1940.0084. (原始內容存檔於2022-07-03) (英語).
- ^ Gillespie, R. J.; Nyholm, R. S. Inorganic stereochemistry. Quarterly Reviews, Chemical Society. 1957-01-01, 11 (4) [2024-04-13]. ISSN 0009-2681. doi:10.1039/QR9571100339. (原始內容存檔於2024-06-15) (英語).
- ^ Gillespie, R. J. The electron-pair repulsion model for molecular geometry. Journal of Chemical Education. 1970-01, 47 (1) [2024-04-13]. ISSN 0021-9584. doi:10.1021/ed047p18. (原始內容存檔於2023-02-11) (英語).
- ^ Baran, E (2000). "Mean amplitudes of vibration of the pentagonal pyramidal XeOF5− and IOF52− anions". Journal of Fluorine Chemistry 101: 61. doi:10.1016/S0022-1139(99)00194-3.
- ^ Wiberg, Egon; Wiberg, Nils. Inorganic Chemistry. Arnold Frederick Holleman. Academic Press. 2001: 1165. ISBN 0123526515.
- ^ Peterson, S. W.; Holloway, J. H.; Coyle, B. A.; Williams, J. M. Antiprismatic Coordination about Xenon: The Structure of Nitrosonium Octafluoroxenate(VI). Science. 1971-09-24, 173 (4003): 1238–1239 [2022-04-04]. ISSN 0036-8075. doi:10.1126/science.173.4003.1238. (原始內容存檔於2022-04-04) (英語).
- ^ Hanson, Robert M. Molecular origami: precision scale models from paper. University Science Books. 1995. ISBN 093570230X.
- ^ 9.0 9.1 9.2 9.3 9.4 Models of molecular geometry, Gillespie R. J., Robinson E.A. Chem. Soc. Rev., 2005, 34, 396–407, doi: 10.1039/b405359c
- ^ Landis, C. K.; Cleveland, T.; Firman, T. K. Making sense of the shapes of simple metal hydrides. J. Am. Chem. Soc. 1995, 117, 1859–1860.
- ^ Landis, C. K.; Cleveland, T.; Firman, T. K. Structure of W(CH3)6. Science 1996, 272, 182–183.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Core Distortions and Geometries of the Difluorides and Dihydrides of Ca, Sr, and Ba Bytheway I, Gillespie R.J, Tang T.H., Bader R.F. Inorganic Chemistry, 34,9, 2407–2414, 1995 doi:10.1021/ic00113a023
- ^ Power, Philip P. Silicon, germanium, tin and lead analogues of acetylenes. Chem. Commun. September 2003, (17): 2091–2101. PMID 13678155. doi:10.1039/B212224C.
- ^ Nagase, Shigeru; Kobayashi, Kaoru; Takagi, Nozomi. Triple bonds between heavier Group 14 elements. A theoretical approach. J. Organomet. Chem. 6 October 2000, 11 (1–2): 264–271. doi:10.1016/S0022-328X(00)00489-7.
- ^ Sekiguchi, Akira; Kinjō, Rei; Ichinohe, Masaaki. A Stable Compound Containing a Silicon–Silicon Triple Bond (PDF). Science. September 2004, 305 (5691): 1755–1757. Bibcode:2004Sci...305.1755S. PMID 15375262. S2CID 24416825. doi:10.1126/science.1102209.[永久失效連結]
- ^ A spectroscopic determination of the bond length of the LiOLi molecule: Strong ionic bonding, D. Bellert, W. H. Breckenridge, J. Chem. Phys. 114, 2871 (2001); doi:10.1063/1.1349424
- ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 978-0-19-855370-0
- ^ Housecroft, C. E.; Sharpe, A. G. Inorganic Chemistry 2nd. Prentice Hall. 2004. ISBN 978-0130399137.
