染色体构象捕获
染色体构象捕获[1](英语:Chromosome conformation capture,简称为3C)是一种用于分析细胞自然状态下染色体组织形式的高通量分子生物学技术。对于理解并评价基因调控、DNA复制和修复来说,研究染色体的结构性质和空间组织是尤为重要的。
影响基因表达的染色质相互作用的例子之一是:染色体区域折叠可以将增强子及相关转录因子带到基因附近,这一点首次在β-珠蛋白结构域中获得证实[2]。染色体构象捕获使得研究者们可以根据上述的细胞机制来研究对染色质活性产生影响的因素。这一技术对研究模式生物和人体中遗传学及表观遗传学很有帮助。
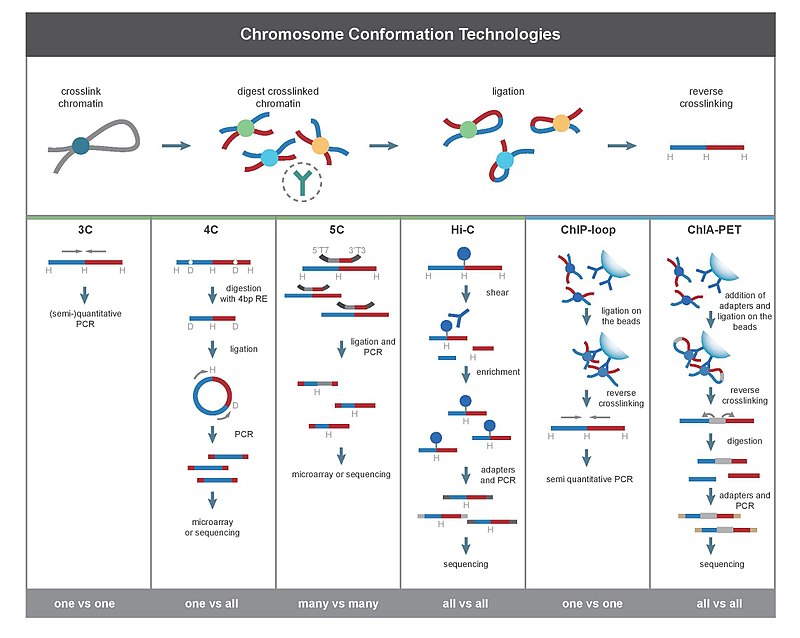
基于原始的3C技术,现已发展出多项新的技术,这些技术可增加一条染色体与其它染色体及其它蛋白之间进行定量的通量。这些所有的3C相关的技术大致可被分为四类:(1)3C和ChIP版本的3C(ChIP-loop assay)、(2)4C和ChIP版本的4C(增强型4C)、(3)5C和3D检测以及(4)基因组构象捕获(GCC)相关技术(Hi-C)和ChIP版本的GCC(也被称为6C)。在4C、5C和Hi-C中通过微阵列和高通量测序手段对DNA片段进行分析的应用使得对染色体交互作用的分析进入全基因组规模。
历史
[编辑]很久之前, 显微镜学是研究细胞核结构[3]最主要的方法, 该方法最早可以追溯到1590 [4].

1879年,华尔瑟·弗莱明(Walther Flemming)首先命名了染色质[5]。
1883年,奥古斯特·魏斯曼(August Weismann)发现了染色质是主要遗传物质。
1884年,阿尔布雷希特·科塞尔(Albrecht Kossel)发现了组蛋白。
1888年,Sutton和Boveri提出了染色质在细胞循环中是连续的理论[6]。
1889年,Wilhelm von Waldemeyer命名了染色体[7]。
1928年,Emil Heitz命名了异染色质和真染色质[8]。
1942年,Conrad Waddington首次假设了表观遗传结构的存在(epigenetic landscapes) [9]。
1948年,R. D. Hotchkiss发现了DNA甲基化[10]。
1953年,沃森和克里克发现了DNA的双螺旋结构[11]。
1961年,玛莉·里昂(Mary Lyon)提出了X染色体去活化的假设。
1973-1974年,染色质纤维(chromatin fiber)被发现[9]。
1982年,染色体领域(Chromosome territories)被发现[12]。
1984年,John T. Lis发明了染色质免疫沉淀技术。
2002年,Job Dekker及其同事发明了3C技术。
2003年,人类基因组计划完成。
2006年,Marieke Simonis 发明了4C技术[13], 同年,Dostie 发明了 5C 技术[14]。
2007年,B. Franklin Pugh发明了染色质免疫沉淀-测序技术[15]。
2009年,Liebermann-Aiden发明了高通量染色体构象捕获技术(Hi-C)[16], 同年,Melissa J. Fullwood发明了ChIA-pet技术. [17]。
2012年,Bin Ren实验室发现并定义了拓扑相关结构域(Topologically Associated Domains,TADs) [18]。
实验方法
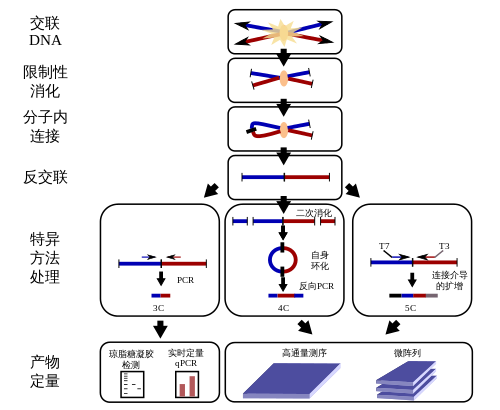
[编辑]所有基于3C的方法都从相似的步骤开始。
步骤一: 交联: 加入甲醛可以使 DNA 与蛋白或蛋白与蛋白之间相互粘结, 这样会导致相互作用的 DNA 片段被交联在一起. (for example cis located promoters to trans located promoters, reveals interactions like the interaction between H enhancer and odorant receptor promoters).
步骤二: 限制酶消化: 加入过量限制性内切酶将未交联的 DNA 与交联的 DNA 相互分离. 限制酶的选择取决于需要分析的基因座位的情况. 限制序列较短 (4 bp) 的内切酶切点密集, 用于研究较短的座位 (< 10~20 kb), 而限制序列较长 (6 bp) 的内切酶用于研究较长的座位.
步骤三: 分子内连接:

在使用低剂量 DNA 底物的情况下, DNA 末端链接反应更偏好于将临近的 DNA 片段连接而非随机进行连接. 这种情况下, 两类连接反应会更频繁出现: 其一是限制酶未完全消化的 DNA 切口被重新连接, 这种情况大致占全部接口的 20% 到 30%, 此类连接与染色质构象捕获实验无关, 我们可以通过降低第一步交联反应的紧密程度来减少这类反应; 另一类频繁发生的连接反应是同一分子内的 DNA 的末端由于距离较近被连接, 这样的接口占到了全部接口的 30% 左右, 这类连接也会发生在交联后形成的蛋白与 DNA 复合物中不同 DNA 链之间 (图中展示的连接为复合物中相同来源 (红色) 的 DNA 末端被连接, 此外不同来源的 DNA 也可能被连接 (红色与蓝色之间). [19]
步骤四: 去交联: 步骤一中的交联可以通过高温去除, 所得到的 DNA 将在其序列两端与当中含有限制酶识别序列, 将这些 DNA 建成文库 (3C 库).
步骤五: 定量: 使用连接位点两端的引物进行聚合酶链式反应, 其结果可以半定量的表示 DNA 片段之间的相互作用. Quantitative PCR using Taqman probes (3C-qPCR) provides a more quantitative measurement of the fragment of interest. The Taqman probe and a constant primer hybridize to the restriction fragment that contains the site of contact and one test primer is designed against each neighboring restriction fragments. Together the probe and primers allow for a specific fluorescent signal to be emitted during amplification.[20]
方法对比
[编辑]3C (one-vs-one)
[编辑]主要捕捉点对点的染色体交联。
4C (one-vs-all)
[编辑]主要捕捉一个特定位点对其他所有位置的染色体交联。
5C (many-vs-many)
[编辑]主要捕捉多位点之前的染色体交联。
Hi-C (all-vs-all)
[编辑]Hi-C使用了高通量测序的方法,理论上它能够捕捉到所有的染色体交联。
生物学意义
[编辑]3C方法已经从很多方法帮助了科学家更加深入的了解细胞核结构和基因调控,包括染色体新结构特征的发现,染色质环,以及对转录调控机制(破坏可能导致疾病)的理解增加。[3]
3C方法已经证明调控元件与其调控的基因在空间上接近的重要性。例如,在表达球蛋白基因的组织中,β-球蛋白基因座控制区与这些基因形成环。在没有表达基因的组织中没有发现该环。[21] 这项技术进一步帮助了模式生物和人类染色体的遗传和[表观遗传学]研究。Template:Citation needed lead
这些方法也同时揭示出了生物细胞核内存在着大量的拓扑相关结构域, 这些TADs与表观遗传标记紧密相连. 一些TAD具有转录活性,而另一些则被抑制。[22] 在黑腹果蝇,小鼠和人类中发现了许多TADs[23]. 此外,CTCF和Cohesin在确定TAD和增强子 - 启动子相互作用中起重要作用。结果表明,增强子 - 启动子环中CTCF结合Motif的方向应该彼此面对以使增强子找到其正确的启动子[24].
人类疾病相关研究
[编辑]本文[25]综述了启动子 - 增强子相互作用缺陷引起的几种疾病。
[β地中海贫血]是LCR增强因子缺失引起的某种血液病[26] [27]
Holoprosencephaly是由SBE2增强子元件中的突变引起的头部障碍,其继而减弱SHH基因的产生[28].
PPD2(多指拇指)是由ZRS增强子的突变引起的,这又增强了SHH基因的产生 [29] [30].
[肺腺癌]可能是由MYC基因增强子元件的重复引起的 [31].
[T细胞急性淋巴细胞白血病]]是由于引入了一种新的增强子 [32].
数据分析
[编辑]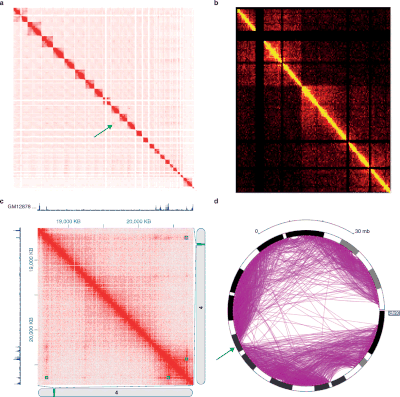
不同的3C-based的实验产生具有不同结构和统计特性的数据。因此,每种实验类型都有特定的分析软件包。 [38]
Hi-C数据通常用于分析全基因组染色质组织,如[拓扑关联域|拓扑关联结构域](TADs),三维空间中与基因组相关的线性连续区域。[22] Several algorithms have been developed to identify TADs from Hi-C data.[39][40]
Hi-C及其后续的数据分析方法很多。Fit-Hi-C [41] 是一种基于离散组合方法的方法,其中修改了相互作用距离(初始样条拟合,又称Spline-1),并改进了空模型(Spline-2)。 Fit-Hi-C的结果是成对的染色体内相互作用与它们的p值和q值的列表。 JuiceBox[42] 是用Java编写的Hi-C数据可视化工具。
基因组的三维组织也可以通过接触矩阵eigendecomposition来分析。每个特征向量对应于共享结构特征的一组轨迹,所述轨迹不一定是线性连续的。[43]
3C技术中一个重要的混杂因素是由于随机[聚合物]行为而发生的基因组位点之间频繁的非特异性相互作用。两个位点之间的相互作用必须通过统计显着性检验确定为特异性。[41]
DNA motif分析
[编辑]DNA motifs是很小(通常8-20)的DNA序列.[44]这些短序列通常高度富集于功能类似的生物序列中(例如许多高表达的基因的启动子中). 目前,远距离染色质相互作用的调节的DNA motif尚未被广泛研究。一些研究集中在阐明DNA基序对启动子 - 增强子相互作用的影响。
郭等人已经确定了在启动子 - 增强子边界序列中的两个CTCF基序的方向对于靶向正确的基因是非常关键的;两个CTCF图案必须相互面对面。[45].
Bailey等人已经鉴定了启动子区域中的ZNF143基序提供了启动子 - 增强子相互作用的序列特异性[46]. Mutation of ZNF143 motif decreased the frequency of promoter-enhancer interactions suggesting that ZNF143 is a novel chromatin-looping factor.
对于基因组规模的分析,在2016年,Wong等人报道了启动子 - 增强子相互作用中K562细胞系的19,491个DNA motif对的列表 [47]. 因此,他们声称,基序配对多样性(与特定基序配对的基序数量)与相互作用距离和调控区域类型有关。在第二年,Wong发表了另外一篇文章,报道了6种人类细胞系中的18,879个motif对儿。[48]. 这项工作的一个新贡献是MotifHyades(用Matlab编写),一个[序列基序发现]工具,可以直接应用于配对序列。
癌细胞分析
[编辑]基于3C的技术可以提供对癌症基因组中染色体重排的见解[49]. 此外,它们可以显示调控元件及其靶基因的空间接近度的变化,这带来了对基因组的结构和功能基础的更深入的理解[50].
Taberlay等人研究了前列腺癌背景下3D基因组组织的破坏 [51]. 拷贝数变异,远距离表观遗传重构和非典型基因表达程序进行了分析。具体而言,他们发现17p13.1上一个TAD(正常)分叉成2个不同的较小的TAD(癌症)。数据可以通过GSE73785在GEO数据库中访问。
Harewood el. al 建议使用Hi-C作为检测染色体重排和拷贝数变异的工具[49]. 癌症数据集由6种脑肿瘤,2种成淋巴细胞系和1种对照细胞系组成。 GEO的登录号是GSE81879。
Ferhat Ay et al. 分析了10癌细胞数据并开发了一系列的工具, 包括鉴定拷贝数变异(HiCnv),染色体间易位(HiCtrans)和Hi-C数据模拟(AveSim) [52]. The datasets are from ENCODE project[53].
罗等人进行了Hi-C实验,发现含有HOXA13基因的抑制性染色质相互作用的锚点中的前列腺癌风险区域(7p15.2) [54]. 3p15.2基因座的缺失可以上调HOXA基因座中的基因。 GEO的登录号是GSE98898。
值得一提的是,ENCODE项目目前(截至2017年12月)在16个细胞系(其中许多是癌细胞系)中有Hi-C数据集, ;它们是A549,ACHN,Caki2,DLD1,G401,HeLa-S3,HepG2,LNCaP克隆FGC,NCI-H460,Panc1,RPMI-7951,SJCRH30,SK-MEL-5,SK-N-DZ,SK- MC,T47D。
另见
[编辑]参考文献
[编辑]- ^ Dekker J, Rippe K, Dekker M, Kleckner N. Capturing chromosome conformation. Science. 2002, 295 (5558): 1306–1311. PMID 11847345. doi:10.1126/science.1067799.
- ^ Tolhuis B, Palstra RJ, Splinter E, Grosveld F and de Laat W. Looping and interaction between hypersensitive sites in the active beta-globin locus. Mol. Cell. 2002, 10 (6): 1453–1465. PMID 12504019. doi:10.1016/S1097-2765(02)00781-5.
- ^ 3.0 3.1 Denker, Annette; de Laat, Wouter. The second decade of 3C technologies: detailed insights into nuclear organization. Genes & Development. 23 June 2016, 30 (12): 1357–1382. PMC 4926860
 . PMID 27340173. doi:10.1101/gad.281964.116.
. PMID 27340173. doi:10.1101/gad.281964.116.
- ^ 存档副本. [2017-12-31]. (原始内容存档于2018-04-22).
- ^ 存档副本. [2017-12-31]. (原始内容存档于2017-12-07).
- ^ MARTINS, L.A.-C.P.. Did Sutton and Boveri propose the so-called Sutton-Boveri chromosome hypothesis?. Genet. Mol. Biol. [online]. 1999, vol.22, n.2 [cited 2017-12-07], pp.261-272. Available from: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1415-47571999000200022&lng=en&nrm=iso (页面存档备份,存于互联网档案馆)>. ISSN 1415-4757. http://dx.doi.org/10.1590/S1415-47571999000200022.
- ^ 存档副本. [2017-12-31]. (原始内容存档于2018-01-29).
- ^ 存档副本. [2017-12-31]. (原始内容存档于2017-01-18).
- ^ 9.0 9.1 9.2 Deichmann, U. (2016). Epigenetics: The origins and evolution of a fashionable topic. Developmental Biology, 416(1), 249–254. https://doi.org/https://doi.org/10.1016/j.ydbio.2016.06.005
- ^ Lu, H., Liu, X., Deng, Y., & Qing, H. (2013). DNA methylation, a hand behind neurodegenerative diseases. Frontiers in Aging Neuroscience, 5, 85. http://doi.org/10.3389/fnagi.2013.00085
- ^ 存档副本. [2017-12-31]. (原始内容存档于2019-09-27).
- ^ Cremer, T., & Cremer, M. (2010). Chromosome Territories. Cold Spring Harbor Perspectives in Biology, 2(3), a003889. http://doi.org/10.1101/cshperspect.a003889
- ^ Simonis, M., Klous, P., Splinter, E., Moshkin, Y., Willemsen, R., & de Wit, E. (2006). Nuclear organization of active and inactive chromatin domains uncovered by chromosome conformation capture-on-chip (4C). Nat Genet, 38. https://doi.org/10.1038/ng1896
- ^ Dostie, J., Richmond, T. A., Arnaout, R. A., Selzer, R. R., Lee, W. L., & Honan, T. A. (2006). Chromosome Conformation Capture Carbon Copy (5C): a massively parallel solution for mapping interactions between genomic elements. Genome Res, 16. https://doi.org/10.1101/gr.5571506
- ^ Albert, I., Mavrich, T. N., Tomsho, L. P., Qi, J., Zanton, S. J., Schuster, S. C., & Pugh, B. F. (2007). Translational and rotational settings of H2A.Z nucleosomes across the Saccharomyces cerevisiae genome. Nature, 446, 572. Retrieved from http://dx.doi.org/10.1038/nature05632
- ^ Lieberman-Aiden, E., van Berkum, N. L., Williams, L., Imakaev, M., Ragoczy, T., & Telling, A. (2009). Comprehensive mapping of long-range interactions reveals folding principles of the human genome. Science, 326. https://doi.org/10.1126/science.1181369
- ^ Fullwood, M. J., Liu, M. H., Pan, Y. F., Liu, J., Xu, H., & Mohamed, Y. B. (2009). An oestrogen-receptor-alpha-bound human chromatin interactome. Nature, 462. https://doi.org/10.1038/nature08497
- ^ Dixon, J. R., Selvaraj, S., Yue, F., Kim, A., Li, Y., Shen, Y., … Ren, B. (2012). Topological Domains in Mammalian Genomes Identified by Analysis of Chromatin Interactions. Nature, 485(7398), 376–380. http://doi.org/10.1038/nature11082
- ^ Dekker J. Personal communication.
- ^ Hagège H, Klous P, Braem C, Splinter E, Dekker J, Cathala G, de Laat W, Forné T. Quantitative analysis of chromosome conformation capture assays (3C-qPCR). Nat. Protoc. 2007, 2 (7): 1722–1733. PMID 17641637. doi:10.1038/nprot.2007.243.
- ^ Tolhuis B, Palstra RJ, Splinter E, Grosveld F, de Laat W. Looping and interaction between hypersensitive sites in the active beta-globin locus. Mol. Cell. 2002, 10 (6): 1453–1465. PMID 12504019. doi:10.1016/S1097-2765(02)00781-5.
- ^ 22.0 22.1 Cavalli, Giacamo. Functional implications of genome topology. Nature Structural & Molecular Biology. 2013, 20 (3): 290–299 [12 June 2016]. doi:10.1038/nsmb.2474. (原始内容存档于2013-05-13).
- ^ J. Dekker, M. A. Marti-Renom, and L. A. Mirny, “Exploring the three-dimensional organization of genomes: interpreting chromatin interaction data,” Nature reviews. Genetics, vol. 14, no. 6. pp. 390–403, Jun-2013.
- ^ Y. Guo et al., “CRISPR Inversion of CTCF Sites Alters Genome Topology and Enhancer/Promoter Function.,” Cell, vol. 162, no. 4, pp. 900–910, Aug. 2015
- ^ Krijger, P. H. L., & de Laat, W. (2016). Regulation of disease-associated gene expression in the 3D genome. Nat Rev Mol Cell Biol, 17(12), 771–782. Retrieved from http://dx.doi.org/10.1038/nrm.2016.138
- ^ Fritsch, E. F., Lawn, R. M. & Maniatis, T. Characterisation of deletions which affect the expression of fetal globin genes in man. Nature 279, 598–603 (1979)
- ^ Van der Ploeg, L. H. et al. γ-Β-Thalassaemia studies showing that deletion of the γ- and δ-genes influences β-globin gene expression in man. Nature 283, 637–642 (1980).
- ^ Jeong, Y., El-Jaick, K., Roessler, E., Muenke, M. & Epstein, D. J. A functional screen for sonic hedgehog regulatory elements across a 1Mb interval identifies long-range ventral forebrain enhancers. Development 133, 761–772 (2006)
- ^ Lettice, L. A. et al. A long-range Shh enhancer regulates expression in the developing limb and fin and is associated with preaxial polydactyly. Hum. Mol. Genet. 12, 1725–1735 (2003)
- ^ Wieczorek, D. et al. A specific mutation in the distant sonic hedgehog (SHH) cis-regulator (ZRS) causes Werner mesomelic syndrome (WMS) while complete ZRS duplications underlie Haas type polysyndactyly and preaxial polydactyly (PPD) with or without triphalangeal thumb. Hum. Mutat. 31, 81–89 (2010).
- ^ Zhang, X. et al. Identification of focally amplified lineage-specific super-enhancers in human epithelial cancers. Nat. Genet. 48, 176–182 (2016)
- ^ Mansour, M. R. et al. Oncogene regulation. An oncogenic super-enhancer formed through somatic mutation of a noncoding intergenic element. Science 346, 1373–1377 (2014).
- ^ Lajoie, Bryan R; van Berkum, Nynke L; Sanyal, Amartya; Dekker, Job. My5C: web tools for chromosome conformation capture studies. Nature Methods. 1 October 2009, 6 (10): 690–691. doi:10.1038/nmeth1009-690.
- ^ Deng, Xinxian; Ma, Wenxiu; Ramani, Vijay; Hill, Andrew; Yang, Fan; Ay, Ferhat; Berletch, Joel B.; Blau, Carl Anthony; Shendure, Jay; Duan, Zhijun; Noble, William S.; Disteche, Christine M. Bipartite structure of the inactive mouse X chromosome. Genome Biology. 7 August 2015, 16 (1). doi:10.1186/s13059-015-0728-8.
- ^ Rao, Suhas S.P.; Huntley, Miriam H.; Durand, Neva C.; Stamenova, Elena K.; Bochkov, Ivan D.; Robinson, James T.; Sanborn, Adrian L.; Machol, Ido; Omer, Arina D.; Lander, Eric S.; Aiden, Erez Lieberman. A 3D Map of the Human Genome at Kilobase Resolution Reveals Principles of Chromatin Looping. Cell. December 2014, 159 (7): 1665–1680. doi:10.1016/j.cell.2014.11.021.
- ^ Zhou, Xin; Lowdon, Rebecca F; Li, Daofeng; Lawson, Heather A; Madden, Pamela A F; Costello, Joseph F; Wang, Ting. Exploring long-range genome interactions using the WashU Epigenome Browser. Nature Methods. 29 April 2013, 10 (5): 375–376. doi:10.1038/nmeth.2440.
- ^ Yardımcı, Galip Gürkan; Noble, William Stafford. Software tools for visualizing Hi-C data. Genome Biology. 3 February 2017, 18 (1). doi:10.1186/s13059-017-1161-y.
- ^ Schmitt, AD; Hu, M; Ren, B. Genome-wide mapping and analysis of chromosome architecture.. Nature Reviews Molecular Cell Biology. December 2016, 17 (12): 743–755. PMID 27580841. doi:10.1038/nrm.2016.104.
- ^ 引用错误:没有为名为
Rao 2014的参考文献提供内容 - ^ Dixon, Jesse R.; Selvaraj, Siddarth; Yue, Feng; Kim, Audrey; Li, Yan; Shen, Yin; Hu, Ming; Liu, Jun S.; Ren, Bing. Topological domains in mammalian genomes identified by analysis of chromatin interactions. Nature. 11 April 2012, 485 (7398): 376–380. PMC 3356448
 . PMID 22495300. doi:10.1038/nature11082.
. PMID 22495300. doi:10.1038/nature11082.
- ^ 41.0 41.1 Ay, F.; Bailey, T. L.; Noble, W. S. Statistical confidence estimation for Hi-C data reveals regulatory chromatin contacts. Genome Research. 5 February 2014, 24 (6): 999–1011. PMC 4032863
 . PMID 24501021. doi:10.1101/gr.160374.113.
. PMID 24501021. doi:10.1101/gr.160374.113.
- ^ N. C. Durand et al., “Juicebox Provides a Visualization System for Hi-C Contact Maps with Unlimited Zoom,” Cell Syst., vol. 3, no. 1, pp. 99–101, Oct. 2017.
- ^ Imakaev, Maxim; Fudenberg, Geoffrey; McCord, Rachel Patton; Naumova, Natalia; Goloborodko, Anton; Lajoie, Bryan R; Dekker, Job; Mirny, Leonid A. Iterative correction of Hi-C data reveals hallmarks of chromosome organization. Nature Methods. 2 September 2012, 9 (10): 999–1003. PMC 3816492
 . PMID 22941365. doi:10.1038/nmeth.2148.
. PMID 22941365. doi:10.1038/nmeth.2148.
- ^ F. Zambelli, G. Pesole, and G. Pavesi, “Motif discovery and transcription factor binding sites before and after the next-generation sequencing era.,” Brief. Bioinform., vol. 14, no. 2, pp. 225–37, Mar. 2013
- ^ Guo Y, Xu Q, Canzio D, et al. CRISPR Inversion of CTCF Sites Alters Genome Topology and Enhancer/Promoter Function. Cell. 2015;162(4):900-910. doi:10.1016/j.cell.2015.07.038.
- ^ Bailey, S. D., Zhang, X., Desai, K., Aid, M., Corradin, O., Cowper-Sal·lari, R., … Lupien, M. (2015). ZNF143 provides sequence specificity to secure chromatin interactions at gene promoters. Nature Communications, 2, 6186. Retrieved from http://dx.doi.org/10.1038/ncomms7186
- ^ K. Wong, Y. Li, and C. Peng, “Identification of coupling DNA motif pairs on long-range chromatin interactions in human,” vol. 32, no. September 2015, pp. 321–324, 2016.
- ^ Ka-Chun Wong; MotifHyades: expectation maximization for de novo DNA motif pair discovery on paired sequences, Bioinformatics, Volume 33, Issue 19, 1 October 2017, Pages 3028–3035, https://doi.org/10.1093/bioinformatics/btx381
- ^ 49.0 49.1 L. Harewood et al., “Hi-C as a tool for precise detection and characterisation of chromosomal rearrangements and copy number variation in human tumours,” pp. 1–11, 2017.
- ^ P. C. Taberlay et al., “Three-dimensional disorganization of the cancer genome occurs coincident with long-range genetic and epigenetic alterations.,” Genome Res., vol. 26, no. 6, pp. 719–731, Jun. 2016.
- ^ Taberlay, P. C., Achinger-Kawecka, J., Lun, A. T. L., Buske, F. A., Sabir, K., Gould, C. M., … Clark, S. J. (2016). Three-dimensional disorganization of the cancer genome occurs coincident with long-range genetic and epigenetic alterations. Genome Research, 26(6), 719–731. https://doi.org/10.1101/gr.201517.115
- ^ A. Chakraborty and F. Ay, “Identification of copy number variations and translocations in cancer cells from Hi-C data,” 2017.
- ^ 存档副本. [2017-12-31]. (原始内容存档于2021-03-28).
- ^ Luo, Z., Rhie, S. K., Lay, F. D., & Farnham, P. J. (2017). A Prostate Cancer Risk Element Functions as a Repressive Loop that Regulates HOXA13. Cell Reports, 21(6), 1411–1417. https://doi.org/10.1016/j.celrep.2017.10.048