阿托莫西汀
 | |
 | |
| 临床资料 | |
|---|---|
| 其他名称 | (R)-N-Methyl-3-phenyl-3-(o-tolyloxy)propan-1-amine |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a603013 |
| 怀孕分级 |
|
| 给药途径 | 口服(胶囊剂,10、18、25、40、60、80和100毫克) |
| ATC码 | |
| 法律规范状态 | |
| 法律规范 |
|
| 药物动力学数据 | |
| 生物利用度 | 63 to 94% |
| 血浆蛋白结合率 | 40% |
| 药物代谢 | 肝脏,通过CYP2D6 |
| 生物半衰期 | 5小时 |
| 排泄途径 | 肾脏(>80%)和粪便(<17%) |
| 识别信息 | |
| |
| CAS号 | 83015-26-3 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.120.306 |
| 化学信息 | |
| 化学式 | C17H21NO |
| 摩尔质量 | 255.355 g/mol 291.820 g/mol (hydrochloride) |
| 3D模型(JSmol) | |
| |
| |
阿托莫西汀[1](USAN:atomoxetine)或托莫西汀[2][3](INN:tomoxetine),商品名“思锐”或“择思达”(Strattera),属于一种选择性去甲肾上腺素再摄取抑制剂,是美国食品和药品监督管理局批准的第一种用于治疗儿童和成人注意(力)缺陷多动障碍(ADHD)的非兴奋剂药物[4][5](非中枢神经刺激药物)。
主要副作用有:口干、疲倦等。该药为去甲肾上腺素再摄取抑制剂(NRI)。主要用来治疗注意(力)缺陷多动障碍(ADHD)患者的症状。去甲肾上腺素是脑中调节注意力、搏动性和活动水平的重要物质,该药主要透过阻断或减缓去甲肾上腺素的再摄取使得去甲肾上腺素浓度增加而发挥作用。[6]阿托莫西汀被归类为去甲肾上腺素再回收抑制剂,主要用于改善注意(力)缺陷多动障碍(ADHD)的核心症状。其具有些微缓解抑郁的作用。根据美国精神医学会的文献,在注意力不足过动症的药物治疗中,阿托莫西汀有时与中枢神经刺激剂一起使用。[7]
这种化合物由礼来公司以品牌名称Strattera在美国制造、营销和销售。礼来是最初申请其为专利的公司,也拥有其在美国的专利。美国以外地区有其非原厂药物出售,制造药厂包括Torrent药厂(品牌名称Tomoxetin)、兰伯西实验室(品版名称Attentin)、太阳制药公司和INTAS生物制药。其非原厂药物目前还没有直接在美国生产,因为它在美国的专利直到2017年才到期。[8]
化学成分
[编辑]阿托莫西汀的化学性质为 (-)-N-甲基-3-苯基-3-(O-甲苯基缩水甘油醚)-丙胺盐酸盐,而其分子量为291.82。溶解度为27.8毫克/毫升水。
阿托莫西汀是一种白色固体颗粒,与预糊化淀粉与二甲基硅油一同放于胶囊内。
阿托莫西汀的胶囊壳含有明胶、十二烷基硫酸钠、FD&C蓝色2号、合成黄色氧化铁、钛白粉、氧化铁红、食用黑墨水和微量其他非活性成分。
药理学
[编辑]阿托莫西汀抑制去甲肾上腺素转运体、5-羟色胺转运体和多巴胺转运体。解离常数的基值分别为5、77和1451。
微透析研究中显示,它使前额叶皮层的去甲肾上腺素和多巴胺浓度增加3倍,但并没有改变在纹状体或伏隔核的多巴胺浓度。阿托莫西汀对血清素、胆碱、肾上腺素受体具有小许亲和力。[9][10]
介绍
[编辑]
阿托莫西汀为去甲肾上腺素再摄取抑制剂,被批准用于儿童、青少年和成年注意(力)缺陷多动障碍(ADHD)患者。阿托莫西汀与中枢神经兴奋剂同样为治疗注意(力)缺陷多动障碍(ADHD)的第一线药物,然而其对特定症状改善的程度可能与中枢神经兴奋剂不同(两类药物各有其长处)。阿托莫西汀的疗效没有在六岁以下儿童研究过。
临床测试显示,阿托莫西汀可提供24小时的注意(力)缺陷多动障碍(ADHD)症状的改善。阿托莫西汀的治疗效果可能需要开始服药后一个星期才会逐渐被患者或患者周遭的人感受到。阿托莫西汀的药效会在开始服用后4~8周完全显现,此时是患者决定是否继续增加剂量的适当时机。注意(力)缺陷多动障碍(ADHD)患者如果对中枢神经兴奋剂没有反应、反应不佳或过敏,可考虑使用阿托莫西汀。患者可向医生询问,共同制定一个渐进的剂量法,以尽量减少副作用的发生。
由于本药物可能导致肝功能受损,建议用药者定期追踪自己的肝功能、血液。
与中枢神经兴奋剂相比
[编辑]纵然阿托莫西汀与中枢神经兴奋剂同样为治疗注意(力)缺陷多动障碍(ADHD)的第一线药物,然而其对特定症状改善的程度可能与中枢神经兴奋剂不同(两类药物各有其长处)。阿托莫西汀在改善“过动-冲动”的症状上,略优于派甲酯;派甲酯则在改善“分心”的症状上,略优于阿托莫西汀。 [11]
而阿托莫西汀与哌甲酯(methylphenidate)并服的处方尚未经美国食品药物管理局核可,但医师会视个案的情况(如:共病、预后、......)以开仿单标示外使用(off-label use)的方式处方之。[12]
历史
[编辑]Strattera最初打算成为一种新的抗抑郁药,但在临床试验中,疗效没有想像中这么强。由于去甲肾上腺素被认为是形成注意(力)缺陷多动障碍(ADHD)的重要因素,Strattera随后用来测试治疗注意(力)缺陷多动障碍(ADHD),最后成功获批。
命名
[编辑]阿托莫西汀最初被称为“Tomoxetine”。然而,因为“Tomoxetine”与“它莫西芬”(tamoxifen,乳腺癌的药物)名称相似,美国食品和药物管理局(FDA)要求更改名称,以免导致在药房配药失误。
剂量
[编辑]| 体重 | 每天服用的起始剂量(Initial Daily Dose) | 总计每天服用的目标剂量(Target Total Daily Dose) | 总计每天服用剂量的上限(Maximum Total Daily Dose) |
|---|---|---|---|
| 年龄小于18岁且体重小于70公斤 | 0.5 毫克/每公斤(mg/Kg) | 1.2 毫克/每公斤(mg/Kg) | 1.4 毫克/每公斤(mg/Kg) |
| 年龄大于或等于18岁或年龄小于18岁且体重大于70公斤 | 40 毫克/天(mg/day) | 80 毫克/天(mg/day) | 100 毫克/天(mg/day) |
- 建议剂量与种族无关。
药品最新的仿单(说明书)并无提到不同种族与剂量之间的关系。 - 总计每天服用剂量的上限 = 无论分几次服用,一天之内最多可摄取的剂量。
- “每天的起始剂量”应服用至少三天,使身体适应后,才可开始服用“每天的目标剂量”。
符合以下条件者,其建议剂量须低于上表:
- 肝功能受损者
- CYP2D6的代谢功能较慢者。
- 同时正在服用具有强抑制CYP2D6代谢的药物。
- 肝功能不全所引起的黄疸
副作用和注意
[编辑]少见
[编辑]极少见
[编辑]烦躁、恶心、食欲下降、便秘、头晕、出汗、排尿困难、性问题、性欲减退、尿潴留、增加强迫行为、体重变化、心悸、增加心率和血压。
极罕见
[编辑]包括情绪波动、情绪障碍、抑郁症、异常的思维模式、自杀念头或倾向、自我伤害和瞳孔散大导致视物模糊。偶尔长时间使用后部分患者有轻度抑郁症、疲倦和健忘。
注意
[编辑]FDA已在2004年发出了警告指出,本药物可能引起肝损害,建议服药者(特别是有轻微肝肾功能问题或黄疸患者)定期追踪肝功能。[14][15][16]
潜在的滥用
[编辑]阿托莫西汀是一种低成瘾风险的药物,并不产生如其他多动症药物的强烈刺激作用。
实验使用
[编辑]临床精神医学杂志载有一临床双盲试验,测试阿托莫西汀治疗暴饮暴食症的效力。该实验人数仅40人,为期10周。结果是托莫西汀“显著减少暴饮暴食频率”。平均每日剂量为106毫克/天。作者的结论是阿托莫西汀有效短期治疗暴饮暴食症。另外,美国杜克大学医学中心在一为期12周的随机对照试验,研究阿托莫西汀对成年肥胖妇女的效用。这项研究的30名肥胖妇女的身高体重指数为36.1。其中一半接受阿托莫西汀治疗,疗程后平均体重下降,而另一半接受安慰剂则轻微上升。[17][18]
检测
[编辑]血浆、血清或全血可检测出阿托莫西汀,以诊断是否中毒或协助调查摄取过量而致命的案件。[19]
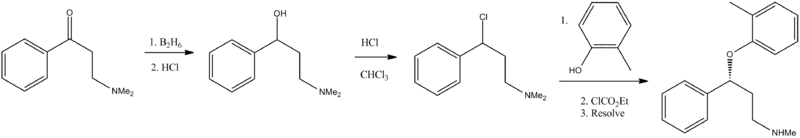
合成
[编辑]福斯特,BJ; Lavagnino,ER,欧洲专利,1982年, EP 0052492 。
参见
[编辑]参考
[编辑]- ^ 陈国美,奚倬勋,杨雪艳,等.盐酸阿托莫西汀的合成改进研究[C]//中国化学会第二十五届学术年会.0[2024-12-03].
- ^ 盐酸托莫西汀胶囊说明书. 丁香园用药助手. [2023-06-28]. (原始内容存档于2023-02-06).
- ^ Preti, A. Tomoxetine (Eli Lilly & Co).. Current opinion in investigational drugs (London, England : 2000). 2002-02, 3 (2): 272–7. PMID 12020059.
- ^ Fu D, Guo HL, Hu YH, Chen F. 托莫西汀在注意力缺陷多动障碍患儿中的精准药学研究:CYP2D6基因检测和治疗药物监测 [A precision medication study of atomoxetine in children with attention deficit hyperactivity disorder: CYP2D6 genetic testing and therapeutic drug monitoring]. Zhongguo Dang Dai Er Ke Za Zhi. 2023 Jan 15;25(1):98-103. Chinese. doi: 10.7499/j.issn.1008-8830.2208092. PMID 36655671; PMCID: PMC9893827.
- ^ 存档副本. [2012-05-15]. (原始内容存档于2012-03-22).
- ^ 存档副本. [2012-05-18]. (原始内容存档于2016-02-16).
- ^ ADHD Parents Medication Guide (PDF). American Psychiatric Association (American Academy of Child & Adolescent Psychiatry and American Psychiatric Association). 2013-07 [2019-05-16]. 原始内容存档于2019-05-16.
- ^ "Drugmaker Eli Lilly loses patent case over ADHD drug, lowers revenue outlook"
- ^ 存档副本 (PDF). [2011-07-09]. (原始内容 (PDF)存档于2013-07-10).
- ^ 存档副本. [2012-05-15]. (原始内容存档于2013-07-10).
- ^ Chi-Yung Shang, Yi-Lei Pan, Hsiang-Yuan Lin, Lin-Wan Huang & Susan Shur-Fen Gau. An Open-Label, Randomized Trial of Methylphenidate and Atomoxetine Treatment in Children with Attention-Deficit/Hyperactivity Disorder. Journal of child and adolescent psychopharmacology. September 2015, 25 (7): 566–573. PMID 26222447. doi:10.1089/cap.2015.0035.
- ^ Parental Medication Guide:American Psychiatric Association with American Academy of Child and Adolescent Psychiatry (PDF). [2017-01-29]. (原始内容存档 (PDF)于2019-08-15).
- ^ Label of Strattera consisting of atomoxetine. Updated June 30, 2015. [2017-01-26]. (原始内容存档于2018-06-07).
- ^ Simpson D, Plosker GL (2004). "Spotlight on atomoxetine in adults with attention-deficit hyperactivity disorder". CNS Drugs 18 (6): 397–401. doi:10.2165/00023210-200418060-00011 PMID 15089111
- ^ 存档副本. [2012-05-15]. (原始内容存档于2012-05-18).
- ^ 存档副本. [2012-05-15]. (原始内容存档于2021-03-09).
- ^ Gadde KM, Yonish GM, Wagner HR, Foust MS, Allison DB (July 2006). "Atomoxetine for weight reduction in obese women: a preliminary randomised controlled trial". International Journal of Obesity 30 (7): 1138–42. doi:10.1038/sj.ijo.0803223 PMID 16418753
- ^ Gadde KM, Yonish GM, Wagner HR, Foust MS, Allison DB (July 2006). "Atomoxetine for weight reduction in obese women: a preliminary randomised controlled trial". International Journal of Obesity 30 (7): 1138–42. doi:10.1038/sj.ijo.0803223 PMID 16418753
- ^ Baselt, Randall C. (2008). Disposition of Toxic Drugs and Chemicals in Man (8th ed.). Foster City, CA: Biomedical Publications. pp. 118–20. ISBN 0-931890-08-X