穆斯堡爾譜學

穆斯堡爾譜學(Mössbauer spectroscopy)是應用穆斯堡爾效應研究物質的微觀結構的學科。穆斯堡爾效應即γ射線的無反衝共振吸收,於1957年由德國物理學家穆斯堡爾發現,並於次年得到實驗驗證。穆斯堡爾效應對環境的依賴性非常高,常利用多普勒效應對γ射線光子的能量進行調製,通過調整γ射線輻射源和吸收體之間的相對速度使其發生共振吸收。吸收率(或者透射率)與相對速度之間的變化曲線叫做穆斯堡爾譜。穆斯堡爾譜的能量解像度非常高,可以用來研究原子核與周圍環境的超精細相互作用。
與核磁共振波譜法相似,穆斯堡爾譜學探測原子核能量水平的微小變化以響應其環境。 通常,可以觀察到三種類型的核相互作用:異構體移位,在舊文獻中也異構物位移位移; 四極分裂; 和磁超精細分裂(參見塞曼效應)。 由於伽馬射線的高能量和極窄的線寬,穆斯堡爾光譜儀在能量(因此頻率)解像度方面是一種非常敏感的技術,能夠檢測到每1011個部分的變化。
應用
[編輯]該技術的缺點之一是有限數量的伽馬射線源和要求樣品是固體以消除核的反衝。 穆斯堡爾譜對其對核的化學環境的細微變化的敏感性是獨特的,包括氧化態變化,不同配體對特定原子的影響以及樣品的磁環境。
作為一種分析工具,穆斯堡爾譜學在地質學領域特別有用,可用於識別包括流星和月球岩石在內的含鐵樣本的成分。 穆斯堡爾光譜的原位數據收集也在火星上富含鐵的岩石上進行[1][2]。 在另一個應用中,穆斯堡爾譜法用於表徵鐵催化劑中的相變,例如用於費托合成的那些鐵催化劑。 雖然最初由赤鐵礦(Fe2O3)組成,但這些催化劑轉變成磁鐵礦(Fe3O4)和幾種碳化三鐵的混合物。 碳化物的形成似乎可以提高催化活性,但是它也會導致催化劑顆粒的機械破碎和磨損,這會導致催化劑最終從反應產物中分離出來[3]。
穆斯堡爾譜學中最常用的是57Fe的能量為14.4 keV 的γ射線,能量解像度可以達到10-13;119Sn也經常用到。穆斯堡爾譜學在物理學、化學、生物學、地質學、冶金學、礦物學、地質學等領域都得到廣泛應用。近年來穆斯堡爾譜學也在一些新興學科,比如材料科學和表面科學領域,開拓了廣泛的應用前景。
生物無機化學
[編輯]穆斯堡爾譜學已廣泛應用於生物無機化學,特別是用於含鐵蛋白質和酶的研究。 該技術通常用於確定鐵的氧化態。 突出的含鐵生物分子的實例是鐵硫蛋白,鐵蛋白和包括細胞色素的血紅素。 這些研究通常通過對相關模型複合體的分析來補充[4][5]。 一個特別感興趣的領域是鐵蛋白參與氧活化的中間體的表徵[6]。
穆斯堡爾譜儀
[編輯]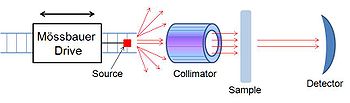
測量穆斯堡爾譜的儀器稱為穆斯堡爾譜儀,由三個主要部件組成。一個移動的γ射線光源,用來產生多普勒效應;一個準直器得到平行光;以及一個檢測器。
微型穆斯堡爾光譜儀,在美因茨大學開發並建造為「MIMOS II」,用於NASA的火星探測漫遊者計劃的兩個火星車勇氣號(Spirit, MER-A)和機遇號(Opportunity, MER-B)任務並分析火星岩石[7]。 除了明確的水證據之外,他們還發現了火星歷史中一個階段的證據,其中大氣中含有的氧氣比現在多得多。
另一個是只有拳頭大小的裝置應該在2013年與俄羅斯探測器"福布斯-土壤"一起落在火衛一上。 在探測器滯留在軌道後,她於2012年1月15日進入地球大氣層並在東太平洋上空燃燒。
延伸閱讀
[編輯]參考資料
[編輯]- ^ Klingelhöfer, G. Mössbauer in situ studies of the surface of Mars. Hyperfine Interactions. 2004, 158 (1–4): 117–124. Bibcode:2004HyInt.158..117K. doi:10.1007/s10751-005-9019-1.
- ^ Schröder, Christian. Mössbauer spectroscopy in astrobiology. Spectroscopy Europe. 2015, 27 (2): 10 [2018-01-08]. (原始內容存檔於2018-01-08).
- ^ Sarkar, A.; et al. Fischer–Tropsch Synthesis: Characterization Rb Promoted Iron Catalyst. Catalysis Letters. 2007, 121 (1–2): 1–11. doi:10.1007/s10562-007-9288-1.
- ^ Martinho, M., Munck, E., "57Fe Mossbauer spectroscopy in chemistry and biology," in 2010, John Wiley & Sons, Inc. doi:10.1002/9780470602539.ch2
- ^ Schuenemann, V., Paulsen, H., "Moessbauer spectroscopy," in 2007, John Wiley & Sons Ltd. ISBN 978-0-470-03217-6.
- ^ Miquel Costas, Mark P. Mehn, Michael P. Jensen, and Lawrence Que, Jr. "Dioxygen Activation at Mononuclear Nonheme Iron Active Sites: Enzymes, Models, and Intermediates" Chem. Rev., 2004, 104 (2), pp 939–986. doi:10.1021/cr020628n
- ^ Klingelhöfer, G.; et al. The miniaturized Mössbauer spectrometer MIMOS II for extraterrestrial and outdoor terrestrial applications: A status report. Hyperfine Interactions. 2002, 144 (1–4): 371–379. Bibcode:2002HyInt.144..371K. doi:10.1023/A:1025444209059.
