氧化還原反應
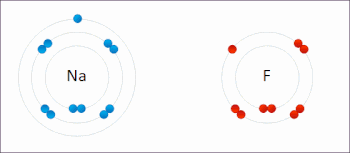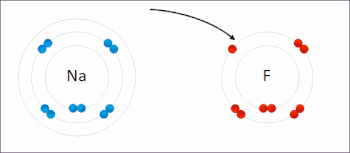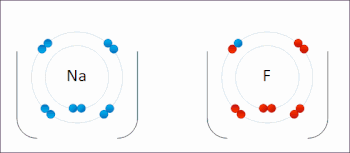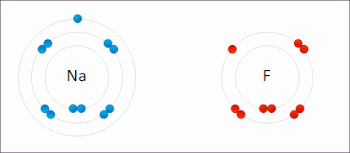
氧化還原反應(英語:Reduction-oxidation reaction)是在反應前後元素的氧化數具有相應的升降變化的化學反應。這種反應可以理解成由兩個半反應構成,即氧化反應和還原反應。此類反應都遵守電荷守恆。在氧化還原反應裏,氧化與還原必然以等量同時進行。
氧化反應指還原劑失去電子,化合價上升;而還原反應是指氧化劑得到電子,化合價下降。
還原劑 + 氧化劑 → 氧化產物(氧化數升高) + 還原產物(氧化數降低)
一般來說,同一反應中還原產物的還原性比還原劑弱,氧化產物的氧化性比氧化劑弱,這就是所謂「強還原劑制弱還原劑,強氧化劑制弱氧化劑」。換言之:
舉個例子︰
被氧化(oxidized), 被還原(reduced)。
定義
[編輯]根據反應的實際情況,氧化還原有不同的定義。
根據電子得失
[編輯]- 氧化:失去電子。
- 還原:得到電子。
這個是最基本、終極的氧化還原的定義,亦是廣義氧化還原的定義[1]。
根據氧化數
[編輯]- 氧化:氧化數升高
- 還原:氧化數降低
有時候很難以電子得失作判斷(例如哈伯法裏面氫氣和氮氣的反應[2],生成物氨並不是離子化合物,電子由雙方共有,沒有一方原子「接受」或「給出」電子),那麽就可以利用氧化數判斷哪一方是被氧化、還原。
根據氧的得失
[編輯]- 氧化:得到氧
- 還原:失去氧
得到氧叫氧化,是最直接的想法。可是因爲不是每個反應都涉及到氧的得失(例如金屬鈉和氯氣的反應),所以這個是狹義氧化還原的定義。
根據氫的得失
[編輯]- 氧化:失去氫
- 還原:得到氫
是一個不太普遍的定義,常用於有機化學、生物化學。例子:一級醇氧化到醛的過程中,碳失去了一個氫,因此那是氧化反應。三級醇不能被氧化劑氧化,原因正是三級碳上沒有氫。而加氫反應(烯烴生成烷烴、苯的伯奇還原[3] 等)等是還原反應。
範例
[編輯]
以酸性條件下過錳酸鹽()與草酸根()做為例子,發生還原反應,故為氧化劑,發生氧化反應,故為還原劑。其還原半反應式為:
而氧化半反應式為:
將兩式中的電子消除得到:
特別例子: 應該注意的是,部分物質在某反應中是氧化劑,在另一個反應中卻是還原劑。二氧化硫就是一個例子。以下方程式為二氧化硫與氧反應,形成三氧化硫:
在這反應中,二氧化硫被氧化,因為硫的氧化數由4 增加至6,二氧化硫是還原劑。 現在再看看另一個例子。 二氧化硫與硫化氫的反應:
在這反應中,二氧化硫被還原成硫,二氧化硫是氧化劑。
所以不可以簡單地說「某物質是氧化劑或還原劑」,需要說明某物質與什麼物質進行化學反應。
氧化還原反應的表現
[編輯]無機物
[編輯]無機物的氧化還原反應表現為一種元素與其他元素化合比例發生了變化。
很多可與氧、氯、硫單質化合的物質在反應中都被氧化。大多數氣態非金屬單質都是較好的氧化劑,而鹼金屬都是還原劑。氫氣、一氧化碳等還原性氣體能把金屬從它們的氧化物中提煉出來,這種還原反應在工業上有重要用途。
氧化反應最早是指金屬或非金屬與氧化合形成氧化物的反應,而還原反應最早是指金屬從其化合物中被還原成單質的反應。
有可變價態的金屬元素,其高價態離子一般有氧化性,低價態離子一般有還原性。如重鉻酸根(Cr(VI))、鐵離子(Fe(III))等是氧化劑,2價錫離子、2價釩離子等是還原劑。
有機物
[編輯]有機物因此而導致的基團變化。有機物的反應也需要氧化劑和還原劑,而且有機分子中的碳原子的氧化數一樣會發生變化。確切的說,發生氧化數變化的碳原子僅限於涉及變化了的基團的少數幾個碳原子,但為了計算方便,計算時可以取平均價態。
雙鍵和三鍵可以被氧化劑氧化而斷開。含氧基團的轉變也屬於氧化還原反應,涉及此類反應的基團包括醇羥基、醛基、酮基和羧基。在適宜的條件下,它們可以互相轉變。另外,多數有α-氫的芳香環取代基能被高錳酸鉀氧化為羧基。
這些反應一般用高錳酸鉀、臭氧、重鉻酸鉀等強氧化性物質作氧化劑,一些有機金屬化合物(如硼氫化鈉、氫化鋁鋰等)及其他有活潑鍵的強還原性物質作還原劑。
與電化學的關係
[編輯]通常氧化還原反應可以做成一個原電池。其中發生氧化反應的一極為陽極,即外電路的負極;還原反應的一極為陰極,即外電路的正極。兩個電極之間有電勢差(電化學上通常叫電動勢),因此反應可以進行,同時可以用來做功。
生物學中的氧化還原反應
[編輯]
許多重要的生物過程都涉及氧化還原反應。在這些過程開始之前,必須從環境中吸收鐵。[4]
例如,細胞呼吸作用是葡萄糖( C6H12O6)氧化為CO2,氧氣還原為水。呼吸作用的總結方程式為:
- C
6H
12O
6 + 6 O
2 → 6 CO
2 + 6 H
2O + 能量
呼吸作用過程也很大程度上依賴NAD+還原為NADH及其逆反應(NADH氧化為NAD+)。光合作用和呼吸作用是互補的,但光合作用並不是呼吸作用中氧化還原反應的逆反應:
- 6 CO
2 + 6 H
2O + 光能 → C
6H
12O
6 + 6 O
2
生物能量通常通過氧化還原反應來儲存和釋放。光合作用涉及將二氧化碳還原為糖,將水氧化為分子氧。逆反應呼吸將糖氧化為二氧化碳和水。作為中間步驟,還原碳化合物用於將煙酰胺腺嘌呤二核苷酸 (NAD+) 還原為NADH,然後有助於產生質子梯度,從而驅動三磷酸腺苷 (ATP) 的合成,並通過氧氣的還原來維持。在動物細胞中,線粒體發揮類似的功能。
地質學中的氧化還原反應
[編輯]
礦物質通常是金屬的氧化衍生物。鐵以磁鐵礦(Fe3O4)的形式開採。鈦以二氧化物的形式開採,通常為金紅石(TiO2)的形式。這些氧化物必須被還原才能得到相應的金屬,通常透過將這些氧化物與碳或一氧化碳作為還原劑加熱來實現。高爐是將氧化鐵和焦炭(碳的一種形式)混合以生產熔鐵的反應堆。產生鐵水的主要化學反應是:[5]
- Fe
2O
3 + 3 CO → 2 Fe + 3 CO
2
土壤中的氧化還原反應
[編輯]電子轉移反應是土壤中無數過程和特性的核心,氧化還原電位(量化為Eh(相對於標準氫電極的鉑電極電位(電壓))或pe(類似於pH的對比電子活度))與pH一樣,是控制化學反應和生物過程的主要變量。早期的理論研究應用於淹水土壤和水稻田生產,對後來土壤中氧化還原和植物根系生長的熱力學研究具有開創性意義。[6]後來的工作則建立在此基礎上,並加以擴展,以瞭解與重金屬氧化狀態變化、成土作用與形態、有機化合物降解與形成、自由基化學、濕地劃分、土壤修復等相關的氧化還原反應,以及各種表徵土壤氧化還原狀態的方法。[7][8]
參見
[編輯]- 氧化 - 還原 - 歧化反應 - 歸中反應
- 取代反應 - 加成反應 - 消去反應
- 化合反應 - 分解反應 - 置換反應 - 複分解反應
- 化學方程式#氧化還原反應化學方程式的配平
- 氧化還原電位
- 還原劑
- 放熱過程
參考文獻
[編輯]- ^ epaper777. 有機物化合物的氧化與還原反應. 大學入學考試中心. [2021-06-17]. (原始內容存檔於2021-06-28).
- ^ Max Appl "Ammonia" in Ullmann's Encyclopedia of Industrial Chemistry 2006 Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_143.pub2
- ^ (a) Birch, A. J. J. Chem. Soc. 1944, 430. (b) Birch, A. J. J. Chem. Soc. 1945, 809. (c) Birch, A. J. J. Chem. Soc. 1946, 593. (d) Birch, A. J. J. Chem. Soc. 1947, 102 & 1642. (e) Birch, A. J. J. Chem. Soc. 1949, 2531.
- ^ Titles of Volumes 1–44 in the Metal Ions in Biological Systems Series. Metals, Microbes, and Minerals - the Biogeochemical Side of Life. De Gruyter. 2021: xxiii–xxiv. ISBN 9783110588903. S2CID 242013948. doi:10.1515/9783110589771-005.
- ^ Oeters, Franz; Ottow, Manfred; Meiler, Heinrich; Lüngen, Hans Bodo; Koltermann, Manfred; Buhr, Andreas; Yagi, Jun-Ichiro; Formanek, Lothar; Rose, Iron, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a14_461.pub2
- ^ Ponnamperuma, F.N. The Chemistry of Submerged Soils. Advances in Agronomy 24. 1972: 29–96. ISBN 978-0-12-000724-0. doi:10.1016/S0065-2113(08)60633-1.
- ^ Bartlett, Richmond J.; James, Bruce R. Redox chemistry of soils. Advances in Agronomy. 1991, 39: 151–208.
- ^ James, Bruce R.; Brose, Dominic A. Oxidation-reduction phenomena. Huang, Pan Ming; Li, Yuncong; Sumner, Malcolm E. (編). Handbook of soil sciences: properties and processes second. Boca Raton, Florida: CRC Press. 2012: 14–1 –– 14–24. ISBN 978-1-4398-0305-9.
外部連結
[編輯]- (英文)Chemical Equation Balancer (頁面存檔備份,存於互聯網檔案館) – An open-source chemical equation balancer that handles redox reactions.
- (英文)Redox reactions calculator (頁面存檔備份,存於互聯網檔案館)
- (英文)Redox reactions at Chemguide (頁面存檔備份,存於互聯網檔案館)
- (英文)Online redox reaction equation balancer, balances equations of any half-cell and full reactions (頁面存檔備份,存於互聯網檔案館)
















