羥胺
外觀
| 羥胺 | |||
|---|---|---|---|
| |||
| |||
| IUPAC名 hydroxylamine | |||
| 識別 | |||
| CAS號 | 7803-49-8 | ||
| PubChem | 787 | ||
| ChemSpider | 766 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | AVXURJPOCDRRFD-UHFFFAOYAD | ||
| Gmelin | 478 | ||
| 3DMet | B01184 | ||
| EINECS | 232-259-2 | ||
| ChEBI | 15429 | ||
| RTECS | NC2975000 | ||
| KEGG | C00192 | ||
| MeSH | Hydroxylamine | ||
| 性質 | |||
| 化學式 | NH 2OH | ||
| 摩爾質量 | 33.0298 g·mol⁻¹ | ||
| 外觀 | 白色固體 | ||
| 密度 | 1.21 g/cm3 | ||
| 熔點 | 33 °C | ||
| 沸點 | 110 °C | ||
| 溶解性(水) | 可溶於冷水,熱水中分解 | ||
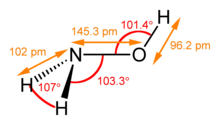
| 結構 | |||
| 偶極矩 | 0.67553 D | ||
| 熱力學 | |||
| ΔfHm⦵298K | −39.9 kJ/mol | ||
| S⦵298K | 236.18 J/(K·mol) | ||
| 危險性 | |||
| 警示術語 | R:R5, R22, R37/38, R41, R43, R48/22, R50 | ||
| 安全術語 | S:S2, S22, S26, S36/37/39, S61 | ||
| 歐盟分類 | Xn, N | ||
| NFPA 704 | |||
| 相關物質 | |||
| 相關化學品 | 鹽酸羥胺、硫酸羥胺 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
1999年來,兩家生產羥胺的工廠發生了爆炸,但羥胺的爆炸性原理尚不明確。[2] 研究表明,二價或三價鐵鹽會催化50%羥胺溶液的分解,羥胺及衍生物最好以鹽的形式儲存。
羥胺有順式和反式兩種異構體,固態時為反式,氣態可能是順式和反式的混合物。
生產
[編輯]NH
2OH的生產方法有以下幾種:
- NH
4NO
2 + 2SO
2 + NH
3 + H
2O → [NH
4]
2[N(OH)(OSO
2)
2] - [NH
4]+
2[N(OH)(OSO
2)
2]2− + H
2O → [NH
4][NH(OH)(OSO
2)] + [NH
4][HSO
4] - 2[NH
4]+
[NH(OH)(OSO
2)]−
+ 2H
2O → [NH
3(OH)]
2[SO
4] + [NH
4]
2[SO
4]
- HNO
2 + 2HSO−
3 → [N(OH)(OSO
2)
2]2− + H
2O → [NH(OH)(OSO
2)]−
+ [HSO
4]− - [NH(OH)(OSO
2)]−
+ H
3O+
(100 °C/1 h) → [NH
3(OH)]+
+ [HSO
4]−
- [NH
3(OH)]Cl + NaOBu → NH
2OH + NaCl + BuOH[1]
反應
[編輯]- R-X + NH
2OH → R-ONH
2 + HX - R-X + NH
2OH → R-NHOH + HX
- R
2C=O + NH
2OH · HCl , NaOH → R
2C=NOH + NaCl + H
2O
肟通常是具有固定熔點的固體,其生成與分解反應可用於純化羰基化合物。丁二酮肟等肟類也是常用的配體試劑。
羥胺與氯磺酸反應生成羥胺-O-磺酸,是生產己內酰胺的原料之一:
- HOSO
2Cl + NH
2OH → NH
2OSO
2OH + HCl
羥胺-O-磺酸應於0°C儲存,使用時也需要用碘量法來測定純度。
- NH
2OH (Zn/HCl) → NH
3 - R-NHOH (Zn/HCl) → R-NH
2
羥胺可與金屬離子配位,且生成的配合物具有鍵合異構:M ← NH2OH 和 M ← ONH3。
用途
[編輯]羥胺及其衍生物的用途有:
安全
[編輯]羥胺對呼吸系統、皮膚、眼部及黏膜具刺激性,吞食有害,為潛在的誘變劑。[5] 羥胺在加熱時可能發生爆炸。
參見
[編輯]參考資料
[編輯]- ^ 1.0 1.1 Greenwood and Earnshaw. Chemistry of the Elements. 2nd Edition. Reed Educational and Professional Publishing Ltd. pp. 431-432. 1997.
- ^ Japan Science and Technology Agency Failure Knowledge Database 網際網路檔案館的存檔,存檔日期2007-12-20..
- ^ Smith, Michael and Jerry March. March's advanced organic chemistry : reactions, mechanisms, and structure. New York. Wiley. p. 1554. 2001.
- ^ Patnaik, Pradyot. Handbook of Inorganic Chemicals. McGraw Hill. pp. 385-386. 2003.
- ^ MSDS Sigma-Aldrich
- Hydroxylamine[失效連結]
- Walters, Michael A. and Andrew B. Hoem. "Hydroxylamine." e-Encyclopedia of Reagents for Organic Synthesis. 2001.
- Schupf Computational Chemistry Lab (頁面存檔備份,存於網際網路檔案館)
- M. W. Rathke A. A. Millard "Boranes in Functionalization of Olefins to Amines: 3-Pinanamine" Organic Syntheses, Coll. Vol. 6, p. 943; Vol. 58, p. 32. (preparation of hydroxylamine-O-sulfonic acid).



