疊氮化合物
| 疊氮化合物 | |
|---|---|

| |
| 識別 | |
| CAS號 | 14343-69-2 |
| 性質 | |
| 化學式 | N− 3 |
| 摩爾質量 | 42.02 g·mol⁻¹ |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
疊氮化合物(英文:azides,hydrazoates,trinitride)在無機化學中,指的是含有疊氮根離子的化合物();在有機化學中,則指含有疊氮基()的化合物。
疊氮根離子
[編輯]疊氮根離子為並非直線型結構,不論是離子型態抑或是有機物皆有微微彎曲(約172°),屬 點群,價電子數為16,和離子、離子、離子,分子是等電子體。疊氮根離子的化學性質類似於鹵離子,例如白色的 AgN3 和 Pb(N3)2 難溶於水。作為配體能和金屬離子形成一系列配合物,如、等[1]。
無機疊氮化物
[編輯]絕大多數疊氮化物進行爆炸分解,但也可通過熱化學、光化學或放電法使其緩慢分解。爆炸分解的結果是產生相應的單質,分解熱即相當於該化合物的標準生成焓。
有些分解產生氮化物:
疊氮化氫的熱分解若在1000oC及低壓條件下進行,產物收集在用液氮冷卻的表面上,可產生氮、氫以及四氮烯:
鹼金屬疊氮化物並不爆炸,只是緩慢分解:
重金屬疊氮化物的分解是由於疊氮根離子的激發,結果一個電子躍遷到導帶,產生疊氮基。基態的疊氮基解離成基態的N和N2是選律禁阻的,解離成激發態的N和N2雖是選律允許的,但需要259kJ/mol的能量,因此在常溫下並不重要。兩個疊氮基之間的相互作用也是選律允許的,並且是個放熱的的過程,因此可以認為這一步在固體離子型疊氮化物的分解中是重要的一步。
疊氮化物迅速分解能導致爆炸點火或起爆,但原因尚不清楚。
疊氮根配位化合物
[編輯]
已知端基配位的較多,橋式的較少。
有機疊氮化合物
[編輯]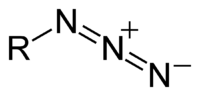
有機疊氮化合物的端基碳具有親核性,並且不穩定容易放出氮氣。Curtius重排反應即經過酰基疊氮中間體。
應用
[編輯]每年大約有250噸疊氮化合物被生產出來,其中主要是疊氮化鈉。[2]
起爆劑與推進劑
[編輯]疊氮化鈉是汽車安全氣囊中的推進劑。加熱時,疊氮化鈉分解產生氮氣,以將氣囊迅速撐開:[2]
一些重金屬疊氮物,例如疊氮化鉛(),是對震動敏感的起爆劑,它們會分解成對應的金屬和氮氣:[3]
疊氮化銀和疊氮化鋇也有類似的應用。有些有機疊氮化合物可能可以用作火箭推進劑,比如2-二甲基氨基乙基疊氮化物(DMAZ)。
其他應用
[編輯]由於疊氮化物的使用具有很高的危險性,即使它們有特殊的反應活性,也很少在商業中使用。
相關
[編輯]參考資料
[編輯]- ^ 劉新錦等.無機元素化學(第二版) 氮族元素.北京:科學出版社.2010.01 ISBN 978-7-03-026399-5
- ^ 2.0 2.1 Jobelius, Horst H.; Scharff, Hans-Dieter. Hydrazoic Acid and Azides. Wiley-VCH Verlag GmbH & Co. KGaA (編). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. 2000-06-15: a13_193. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a13_193 (英語).
- ^ Shriver and Atkins. Inorganic Chemistry (Fifth Edition). New York: W. H. Freeman and Company. : 382.
- 宋天佑等.《無機化學》下冊.北京:高等教育出版社,2004年. ISBN 7-04-015582-6
- 張青蓮等.《無機化學叢書》第四卷,氮磷砷分族.北京:科學出版社,1984年.








![{\displaystyle {\ce {Na2[Sn(N3)6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/92119fe7f97fd882044e3b75ff7546c118a8e491)







