叔丁基亚磺酰胺
外观
| 叔丁基亚磺酰胺 左:R型体,右:S型体 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 2-甲基丙烷-2-亚磺酰胺 2-Methylpropane-2-sulfinamide | |||
| 别名 | 特丁基亚磺酰、2-甲基-2-丙烷亚磺酰胺、埃尔曼亚磺酰胺 | ||
| 识别 | |||
| CAS号 | 146374-27-8((R/S)) 196929-78-9((R)-(+)) 343338-28-3((S)-(-)) | ||
| PubChem | 3382465((R/S)) 10964479((R)-(+)) 11355477((S)-(-)) | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | CESUXLKAADQNTB-UHFFFAOYSA-N | ||
| 性质 | |||
| 化学式 | C4H11NOS | ||
| 摩尔质量 | 121.2 g·mol−1 | ||
| 外观 | 白色或淡黄色固态 | ||
| 熔点 | 102 -105 °C(270 K) | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
叔丁基亚磺酰胺(英語:tert-Butanesulfinamide),学名2-甲基-2-丙烷亚磺酰胺,俗称埃尔曼亚磺酰胺(英語:Ellman's sulfinamide),是一种含硫有机化合物,属亚磺酸酰胺类化合物。两种对应异构体均有市售,并常用作不对称合成的手性助剂,特别是用于合成手性铵盐或胺[1][2][3]。叔丁基亚磺酰胺以及相关的合成方法由乔纳森·A·埃尔曼(Jonathan A. Ellman)等人在1997年提出[4],因此该化合物又称为埃尔曼亚磺酰胺。
对映纯合成
[编辑]对映纯级的叔丁基亚磺酰胺可以由廉价的叔丁基二硫经过立体选择性氧化成硫代亚磺酸酯,再利用氨基锂使二硫键断裂得到。其第一步立体选择性氧化过程用到了乙酰丙酮氧钒(IV)和有机手性配体,该有机手性配体由3,5-二叔丁基水杨醛与光谱纯的手性氨基茚满醇缩合得到。
 |
| 叔丁基亚磺酰胺合成路线 |
|---|
手性胺合成
[编辑]叔丁基亚磺酰胺与酮和醛缩合生成对应的N-叔丁基亚磺酰酮亚胺和N-叔丁基亚磺酰醛亚胺。这类亚胺比一般亚胺更耐水解,但更容易与亲核试剂反应。当亲核试剂(Nu-)与这类亚胺双键发生非对应选择性加成,叔丁基亚磺酰基起到手性助剂的作用。叔丁基亚磺酰基同时也起到的保护基的作用。与盐酸反应即可去掉叔丁基亚磺酰基,形成对应的手性铵盐、手性胺(采用醛为起始原料)或手性仲胺(采用酮为起始原料)
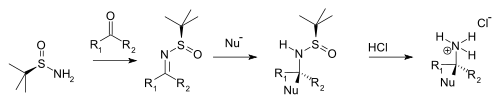 |
| 叔丁基亚磺酰胺的手性胺合成 |
|---|
富兰克林·A·戴维斯在此基础上还开发出以亚磺酰亚胺为中间体的不对称合成胺类化合物的方法[5]。
运用
[编辑]在抗过敏药西替利嗪的不对称合成中(手性体比外消旋体药效更强),就用到了叔丁基亚磺酰胺作为手性助剂。采用4-氯苯甲醛与叔丁基亚磺酰胺缩合得到对应的N-叔丁基亚磺酰醛亚胺,然后与苯基溴化镁加成得到关键的手性中心[6]。
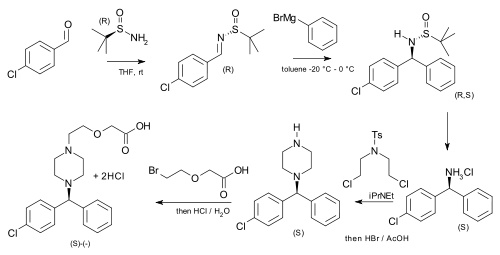 |
| 西替利嗪的不对称合成 |
|---|
参考文献
[编辑]- ^ Ellman, J. A. Applications of tert-butanesulfinamide in the asymmetric synthesis of amines. Pure and Applied Chemistry. 2003, 75: 39–46. S2CID 97201636. doi:10.1351/pac200375010039
 .
.
- ^ Robak, Maryann T.; Herbage, Melissa A.; Ellman, Jonathan A. Synthesis and Applications oftert-Butanesulfinamide. Chemical Reviews. 2010, 110 (6): 3600–740. PMID 20420386. doi:10.1021/cr900382t.
- ^ Organic Syntheses, Vol. 82, p.157 (2005). Link
- ^ Liu, Guangcheng; Cogan, Derek A.; Ellman, Jonathan A. Catalytic Asymmetric Synthesis of tert-Butanesulfinamide. Application to the Asymmetric Synthesis of Amines. Journal of the American Chemical Society. 1997, 119 (41): 9913. doi:10.1021/ja972012z.
- ^ Davis, Franklin A.; Reddy, Rajarathnam E.; Szewczyk, Joanna M.; Reddy, G. Venkat; Portonovo, Padma S.; Zhang, Huiming; Fanelli, Dean; Zhou, Ping; et al. Asymmetric Synthesis and Properties of Sulfinimines (ThiooximeS-Oxides). The Journal of Organic Chemistry. 1997, 62 (8): 2555–2563. PMID 11671597. doi:10.1021/jo970077e.
- ^ Pflum, D; Krishnamurthy, D; Han, Z; Wald, S; Senanayake, C. Asymmetric synthesis of cetirizine dihydrochloride. Tetrahedron Letters. 2002, 43 (6): 923. doi:10.1016/S0040-4039(01)02294-8.


