Β-多肽
外观
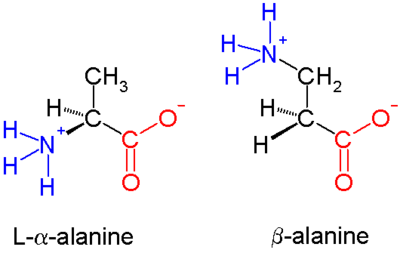
β-多肽(β-peptide)或 beta-多肽,是由β-氨基酸聚合而成的多肽。母体β-氨基酸是H2NCH2CH2COOH,但大多数的情况下,取代基取代了一个或多个CH键。唯一常见的天然存在的β氨基酸是β-丙氨酸。 自然界中一般不存在β-多肽。基于β肽的抗生素有潜力作为防止产生抗生素耐药性的方法[1],1996年由迪特·泽巴赫小组[1]和Samuel H. Gellman小组[2]发表相关的早期研究。
合成
[编辑]存在两种类型的β-多肽:胺旁边具有有机残基(R)的称为β3-多肽,而在羰基旁边具有有机残基(R)的称为β2-多肽[3]。
β-氨基酸可以通过多种途径制备[4][5],包括通过阿恩特-艾斯特尔特合成方法合成。

二级结构
[编辑]因为β-多肽比正常肽的骨架长,所以β-多肽会形成不同的二级结构。 β-氨基酸中α和β位的烷基取代基有利于α-碳和β-碳之间的键的左旋构象,同时也会影响结构的热力学稳定性。
由β-多肽组成的许多类型的螺旋结构有许多报道。这些构象可以通过在溶液中形成的氢键环中的原子数进行分类:8-螺旋、10-螺旋、12-螺旋、14-螺旋[6]和10、12-螺旋。一般来说,β-肽比α-肽可以形成更稳定的螺旋[7]。
临床应用潜力
[编辑]β-肽在体外和体内对蛋白酶解稳定,较天然肽有潜在优势[8]。β-多肽可以用于模拟天然多肽所衍生的抗生素,它们非常有效但因会被蛋白水解酶降解而难以用作药物,例如馬蓋寧[9]。
列表
[编辑]存在8种β结构存在:丙氨酸、亮氨酸、赖氨酸、精氨酸、谷氨酸、谷氨酰胺、苯丙氨酸、酪氨酸的形式[10]。天冬氨酸可以认为同时具有β形式和α形式,尽管β形式存在于微囊藻毒素中 [10]。
相关
[编辑]参考
[编辑]- ^ 1.0 1.1 β-Peptides: Synthesis by Arndt-Eistert homologation with concomitant peptide coupling. Structure determination by NMR and CD spectroscopy and by X-ray crystallography. Helical secondary structure of a -hexapeptide in solution and its stability towards pepsin. Helvetica Chimica Acta. June 1996, 79 (4): 913–941. doi:10.1002/hlca.19960790402.
- ^ β-Peptide Foldamers: Robust Helix Formation in a New Family of -Amino Acid Oligomers. J. Am. Chem. Soc. 1996, 118 (51): 13071–2. doi:10.1021/ja963290l.
- ^ β-Peptides: a surprise at every turn. Chem. Commun. 1997, (21): 2015–22. doi:10.1039/a704933a.
- ^ Conformationally constrained β-amino acid derivatives by intramolecular [2 + 2]-photocycloaddition of a tetronic acid amide and subsequent lactone ring opening. J. Org. Chem. November 2005, 70 (24): 9798–808. PMID 16292808. doi:10.1021/jo0515226.
- ^ Efficient synthesis of a β-peptide combinatorial library with microwave irradiation. J. Am. Chem. Soc. September 2005, 127 (38): 13271–80. PMID 16173757. doi:10.1021/ja052733v.
- ^ Vasantha, Basavalingappa; George, Gijo; Raghothama, Srinivasarao; Balaram, Padmanabhan. Homooligomeric β3 (R)-valine peptides: Transformation between C14 and C12 helical structures induced by a guest Aib residue. Biopolymers. January 2017, 108 (1): e22935 [2022-02-13]. ISSN 1097-0282. PMID 27539268. doi:10.1002/bip.22935. (原始内容存档于2022-02-13).
- ^ Beta-peptides: twisting and turning. Curr. Med. Chem. October 1999, 6 (10): 905–25. PMID 10519905.
- ^ Toward a rational design of β-peptide structures. J Comput Chem. January 2006, 27 (1): 20–38. PMID 16247761. doi:10.1002/jcc.20299.
- ^ Mimicry of host-defense peptides by unnatural oligomers: antimicrobial β-peptides. J. Am. Chem. Soc. 2002, 124 (25): 7324–30. PMID 12071741. doi:10.1021/ja0260871.
- ^ 10.0 10.1 Enantioselective Synthesis of Beta-Amino Acids Sec 2.2, Eusebio Juaristi, Vadim A. Soloshonok
