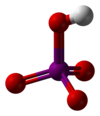
高碘酸
| 高碘酸 | |||
|---|---|---|---|
| |||
| |||

| |||
| 别名 | 碘(VII)酸 | ||
| 识别 | |||
| CAS号 | 10450-60-9(正高碘酸) 13444-71-8(偏高碘酸) | ||
| ChemSpider | 23622 (正高碘酸), 58684 (偏高碘酸) | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | TWLXDPFBEPBAQB-UHFFFAOYSA-N | ||
| UN编号 | UN3085 | ||
| 性质 | |||
| 化学式 | HIO 4(偏高碘酸) H 5IO 6(正高碘酸) | ||
| 摩尔质量 | 190.91 g/mol (HIO 4) 227.941 g/mol (H 5IO 6) g·mol⁻¹ | ||
| 外观 | 无色晶体 | ||
| 熔点 | 128.5 °C(402 K)([1]) | ||
| 溶解性 | 溶于水、醇 | ||
| 危险性 | |||
GHS危险性符号   
| |||
| GHS提示词 | Danger | ||
| H-术语 | H271, H314, H372, H400 | ||
| P-术语 | P210, P260, P273, P303+361+353, P305+351+338 | ||
| NFPA 704 | |||
| 相关物质 | |||
| 其他阴离子 | |||
| 其他阳离子 | |||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
高碘酸是碘的最高含氧酸,其中碘以+7氧化态存在。它可以以两种形式存在:化学式为H5IO6的正高碘酸和化学式为HIO4的偏高碘酸。
高碘酸由海因里希·古斯塔夫·马格努斯和CF Ammermüller于1833年发现。[2]
合成
[编辑]现代工业规模生产涉及碘酸钠溶液在碱性条件下的氧化,或者在PbO
2阳极上进行电化学氧化,或者通过氯处理:[3]
- IO−
3 + 6 HO−
- 2 e−
→ IO5−
6 + 3 H
2O (为方便省略抗衡离子) E° = -1.6 V[4] - IO−
3 + 6 HO−
+ Cl
2 → IO5−
6 + 2 Cl−
+ 3 H
2O
原高碘酸在减压下加热至100℃可脱水得到偏高碘酸。
- H
5IO
6 ⇌ HIO
4 + 2 H
2O
进一步加热至约150 °C得到五氧化二碘(I
2O
5),而不是预期的酸酐[七氧化二碘(I
2O
7)]。偏高碘酸也可由各种正高碘酸盐经稀硝酸处理制得。[5]
性质
[编辑]正高碘酸有多個酸解离常数。[6][7] 偏高碘酸的pKa尚未确定。
- H
5IO
6 ⇌ H
4IO−
6 + H+
, pKa = 3.29
- H
4IO−
6 ⇌ H
3IO2−
6 + H+
, pKa = 8.31
- H
3IO2−
6 ⇌ H
2IO3−
6 + H+
, pKa = 11.60
存在两种形式的高碘酸,因此形成两种类型的高碘酸盐。例如,偏高碘酸钠NaIO4可以由HIO4合成,而正高碘酸钠Na5IO6可以由H5IO6合成。
结构
[编辑]正高碘酸形成单斜晶体(空间群P21/n),由一个轻微变形的IO
6八面体通过桥接氢相互连接组成。五个I-O键距离在1.87-1.91 Å范围内,一个I-O键距离为 1.78 Å。[8][9]
偏高碘酸的结构还包括IO
6八面体,但是它们通过顺共棱与桥氧连接形成一维无限链。[10]
反应
[编辑]像所有高碘酸盐一样,高碘酸可用于裂解各种1,2-双官能团化合物。高碘酸会将邻二醇裂解成两个醛或酮片段(马拉普拉德反应)。

这可用于确定碳水化合物的结构,因为高碘酸可用于打开糖环。该过程通常用于用荧光分子或其他标签(如生物素)标记糖类。由于该过程需要连位二醇,因此高碘酸盐氧化通常用于选择性标记RNA的 3'-末端(核糖具有连位二醇)而不是DNA,因为脱氧核糖没有连位二醇。
高碘酸也被用作中等强度的氧化剂,例如在仲烯丙醇的Babler氧化反应中,通过化学计量的正高碘酸与催化剂PCC将其氧化成烯酮。[11]
参见
[编辑]具有相似结构的化合物:
化学性质相似的化合物:
参考资料
[编辑]- ^ Aylett, founded by A.F. Holleman; continued by Egon Wiberg; translated by Mary Eagleson, William Brewer; revised by Bernhard J. Inorganic chemistry 1st English ed., [edited] by Nils Wiberg. San Diego, Calif. : Berlin: Academic Press, W. de Gruyter. 2001: 453. ISBN 0123526515.
- ^ Ammermüller, F.; Magnus, G. Ueber eine neue Verbindung des Jods mit Sauerstoff, die Ueberjodsäure. Annalen der Physik und Chemie. 1833, 104 (7): 514–525 [2022-07-17]. Bibcode:1833AnP...104..514A. doi:10.1002/andp.18331040709. (原始内容存档于2022-06-07) (German).
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the elements 2nd. Butterworth-Heinemann. 1997: 872. ISBN 978-0-7506-3365-9. doi:10.1016/C2009-0-30414-6.
- ^ Parsons, Roger. Handbook of electrochemical constants. Butterworths Scientific Publications Ltd. 1959: 71.
- ^ Riley. Brauer, Georg , 编. Handbook of preparative inorganic chemistry. Volume 1. 由Scripta Technica, Inc.翻译. Translation editor Reed F. 2nd. New York, N.Y.: Academic Press. 1963: 323–324. ISBN 012126601X.
- ^ Aylett, founded by A.F. Holleman; continued by Egon Wiberg; translated by Mary Eagleson, William Brewer; revised by Bernhard J. Inorganic chemistry 1st English ed., [edited] by Nils Wiberg. San Diego, Calif. : Berlin: Academic Press, W. de Gruyter. 2001: 454. ISBN 0123526515.
- ^ Burgot, Jean-Louis. Ionic equilibria in analytical chemistry. New York: Springer. 2012-03-30: 358. ISBN 978-1441983824.
- ^ Feikema, Y. D. The crystal structures of two oxy-acids of iodine. I. A study of orthoperiodic acid, H5IO6, by neutron diffraction. Acta Crystallographica. 10 June 1966, 20 (6): 765–769. doi:10.1107/S0365110X66001828.
- ^ Fábry, J.; Podlahová, J.; Loub, J.; Langer, V. Structure of the 1:1 adduct of orthoperiodic acid and urea. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 1982, 38 (3): 1048–1050. doi:10.1107/S0567740882004932.
- ^ Kraft, Thorsten; Jansen, Martin. Crystal Structure Determination of Metaperiodic Acid, HIO4, with Combined X-Ray and Neutron Diffraction. Angewandte Chemie International Edition in English. 1 September 1997, 36 (16): 1753–1754. doi:10.1002/anie.199717531.
- ^ Killoran, Patrick M.; Rossington, Steven B.; Wilkinson, James A.; Hadfield, John A. Expanding the scope of the Babler–Dauben oxidation: 1,3-oxidative transposition of secondary allylic alcohols. Tetrahedron Letters. 2016, 57 (35): 3954–3957 [2022-07-17]. doi:10.1016/j.tetlet.2016.07.076. (原始内容存档于2018-07-01) (英语).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||